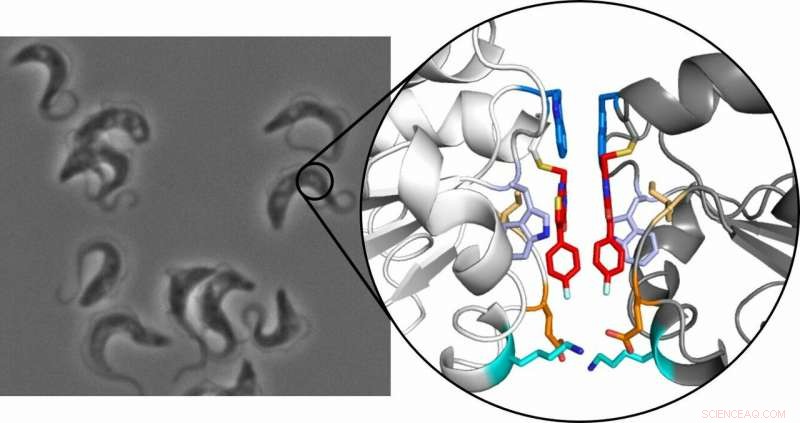
Trypanosomes, qui causent la maladie du sommeil africaine, au microscope (à gauche) et la structure cristalline du dimère de tryparédoxine (à droite) :Les deux molécules inhibitrices sont surlignées en rouge. Crédits :Ute Hellmich, Annika Wagner
Des scientifiques travaillant dans diverses disciplines ont uni leurs forces pour identifier une nouvelle approche pour lutter contre la maladie du sommeil africaine. La recherche fondamentale entreprise sous la direction du professeur Ute Hellmich de l'Université Johannes Gutenberg de Mayence (JGU) a révélé une stratégie prometteuse pour développer un agent approprié. "Il y a encore un long chemin à parcourir avant d'arriver à un produit pharmaceutique, " a déclaré Hellmich. " Mais notre travail hautement interdisciplinaire impliquant la parasitologie, chimie théorique et organique, biologie structurale, et la biochimie a montré comment le parasite qui cause la maladie du sommeil peut être rendu inoffensif. » Les chercheurs ont réussi à démontrer comment une substance inhibitrice spécifique se fixe et désactive une protéine vitale du parasite.
La maladie du sommeil africaine est causée par les trypanosomes, protozoaires unicellulaires transmis par la piqûre d'une mouche tsé-tsé infectée. Selon l'Organisation mondiale de la santé, le nombre de personnes infectées a diminué ces dernières années, jusqu'à environ 15, 000 en 2014. Cependant, il est difficile d'établir l'incidence réelle de la maladie, car les premiers symptômes sont similaires à ceux du paludisme. « Non seulement les personnes les plus pauvres d'Afrique subsaharienne sont menacées, mais aussi leur bétail, qui sont affectées à une échelle dramatique par certaines espèces de Trypanosoma brucei, " a expliqué le biochimiste professeur Ute Hellmich.
Actuellement, seulement une poignée de médicaments pour traiter la maladie du sommeil, qui est mortelle si elle n'est pas traitée, sont disponibles et ces traitements sont souvent accompagnés d'effets secondaires graves et même de décès chez jusqu'à 10 pour cent des patients. Bien que de nouveaux médicaments soient actuellement en cours de développement, l'approche du groupe de Hellmich va plus loin :« Notre inhibiteur ouvre la perspective future de pouvoir concevoir des inhibiteurs à un niveau fondamental et pourrait ainsi éventuellement être utilisé dans le traitement d'infections avec d'autres, parasites pathogènes apparentés, comme Leishmania, " a déclaré Annika Wagner, auteur principal de l'étude récemment publiée dans Angewandte Chemie Édition Internationale .
L'inhibiteur induit la dimérisation de la protéine essentielle du parasite
Le principe repose sur le fait qu'un petit l'inhibiteur sélectif se lie à l'enzyme tryparédoxine. Cette protéine est essentielle pour le parasite, le protéger des dommages oxydatifs, mais n'est pas présent chez l'homme, ce qui en fait une cible médicamenteuse viable. A leur grande surprise, l'équipe de chercheurs a découvert que lorsque l'inhibiteur se lie à la protéine, deux des complexes inhibiteur-protéine résultants se combinent ensuite pour former un dimère stable. Lorsque cela se produit, la protéine habituellement monomérique cesse de fonctionner.
"Nous avons été étonnés et avons d'abord pensé qu'il s'agissait d'un effet aléatoire dû aux conditions expérimentales, " a déclaré Hellmich. L'enquête a ensuite été prolongée, et il a été vérifié dans une étude à grande échelle utilisant diverses méthodes que l'effet de dimérisation pouvait être reproduit. En plus des équipes de recherche de Mayence du professeur Ute Hellmich et du professeur Till Opatz, des chercheurs des universités de Francfort, Wurtzbourg, Heidelberg, et le Laboratoire Européen de Biologie Moléculaire (EMBL) à Grenoble ont été impliqués.
La recherche hautement interdisciplinaire s'avère fructueuse
La dimérisation que la recherche a découverte est inhabituelle car la molécule responsable est extrêmement petite. La plupart des molécules qui agissent comme un adhésif moléculaire pour combiner des monomères individuels pour former un dimère sont relativement grosses. "Notre molécule est beaucoup plus petite et capable de reconnaître directement la protéine, " a expliqué Hellmich. Les petites molécules sont également plus faciles à introduire dans les cellules, qui pourrait être le point de départ de nouveaux concepts de médicaments.
En démontrant précisément le mécanisme par lequel la protéine parasite est chimiquement inhibée et dimérisée par la petite molécule, le partenariat de recherche interdisciplinaire a posé les fondements d'un tel nouveau concept. "Il était crucial que nous ne nous arrêtions pas à notre objectif initial de simplement déterminer la structure cristalline du complexe protéine-inhibiteur, " dit Hellmich. " Au lieu de cela, nous avons revu le résultat et en avons discuté avec des experts de différents domaines. La recherche ne progresse que lorsque nous travaillons ensemble."