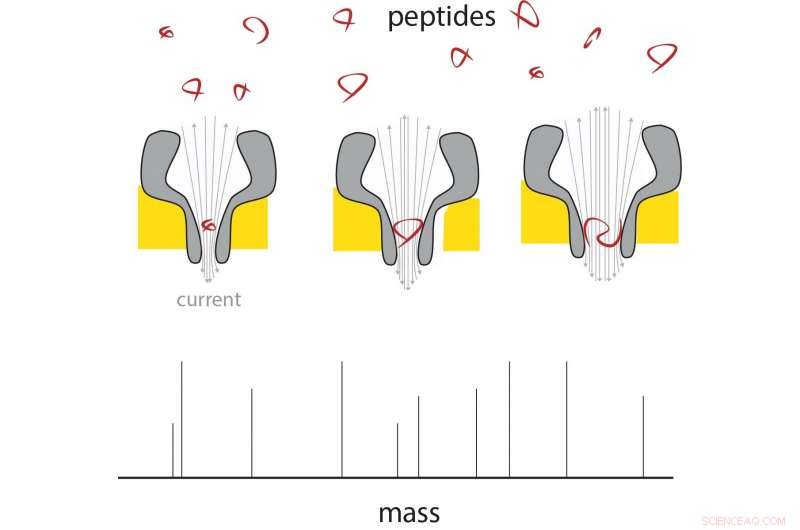
Un peptide pénètre dans l'extrémité fine du nanopore, et là change le courant en proportion de sa masse. En utilisant des nanopores de tailles différentes, une gamme de tailles de peptides peut être mesurée. Crédit :G. Maglia / Université de Groningue
Des scientifiques de l'Université de Groningue ont développé des nanopores pour mesurer directement la masse des peptides. Bien que la résolution doive être améliorée, cette preuve de principe montre qu'un spectromètre de masse peptidique bon marché et portable peut être construit en utilisant la technologie des nanopores existante et les pores brevetés qui ont été développés dans le laboratoire du professeur agrégé de biologie chimique de l'Université de Groningen, Giovanni Maglia. Un article sur cette découverte a été publié dans Communication Nature le 19 février.
Les spectromètres de masse sont précieux pour l'étude des protéines, mais ils sont à la fois encombrants et chers, ce qui limite leur utilisation aux laboratoires spécialisés. "Encore, la prochaine révolution des études biomédicales sera en protéomique, l'analyse à grande échelle de protéines exprimées dans différents types cellulaires, " dit Maglia. Car bien que chaque cellule de votre corps porte le même ADN, la production de protéines diffère énormément d'un type cellulaire à l'autre. "Et aussi, les protéines sont modifiées après leur production, par exemple en ajoutant des sucres qui peuvent affecter leur fonction."
Masse
La technologie des nanopores pourrait offrir un moyen d'analyser des molécules uniques. Dans des travaux antérieurs, Maglia a déjà montré que les nanopores biologiques peuvent être utilisés pour mesurer des métabolites et pour identifier des protéines et des peptides. Ces pores sont de grandes structures protéiques, incorporé dans une membrane. Les molécules entrant dans un pore ou le traversant provoquent une modification du courant électrique à travers le pore. "Un problème dans la mesure de la masse des peptides est qu'ils passent trop rapidement à travers même le plus petit pore biologique pour obtenir une lecture, " explique Maglia.
Faire des pores plus petits était un défi. "Les pores sont constitués d'un certain nombre de monomères, nous avons donc initialement modifié l'interaction entre ces monomères, mais cela n'a pas fonctionné. » L'observation selon laquelle le mélange de monomères avec de plus grandes quantités de lipides - qui composent la membrane - a entraîné un pourcentage plus élevé de pores plus petits a donné à Maglia et à son équipe l'idée de modifier l'interaction entre les monomères et les lipides. en effet conduit à des pores constitués d'un plus petit nombre de monomères, qui a réduit la taille des pores.
Les pores les plus petits jamais créés
Maglia a alors pu produire des pores en forme d'entonnoir qui, à leur extrémité étroite, ne mesurait que 0,84 nanomètre. "Ce sont les plus petits pores biologiques jamais produits." Le prochain défi était de s'assurer que les peptides passeraient à travers les pores, quelle que soit leur composition chimique. "Les pores ont une charge négative, ce qui est nécessaire à leur bon fonctionnement, " explique Maglia.
La charge fait couler l'eau à travers le pore, en traînant les peptides. Mais les peptides chargés négativement seraient repoussés par la charge négative à l'extrémité de l'entonnoir mince. Maglia a modifié la charge en modifiant l'acidité des fluides utilisés. "Finalement, nous avons réussi à trouver les bonnes conditions en fixant l'acidité à un pH d'exactement 3,8. Cela permet aux peptides chargés négativement de passer tout en maintenant un débit d'eau suffisamment important à travers les pores."
Résolution
Des mesures à travers des nanopores de différentes tailles montrent que le courant électrique est linéaire avec le volume du peptide traversant. Ces peptides avaient une longueur de 4 à 22 acides aminés. La différence entre les acides aminés alanine et glutamate pourrait être mesurée dans ce système, ce qui signifie que la résolution est d'environ 40 Dalton (une mesure de la masse de protéines). "La résolution des spectromètres de masse conventionnels est bien meilleure, mais si nous pouvions rendre le système environ quarante fois plus sensible, il serait déjà utile dans la recherche en protéomique, " dit Maglia. Il existe plusieurs façons d'améliorer la résolution, dit Maglia. « Nous pourrions concevoir le nanopore avec des acides aminés artificiels, ou utiliser différents ions dans nos solutions, réduisez le bruit en changeant la température, etc.
Le système nanopore a plusieurs arguments de vente uniques :il mesure des molécules individuelles, la technologie elle-même est déjà disponible dans le commerce et elle est relativement bon marché. Par ailleurs, le système nanopore est portable. Et, en utilisant de nombreux pores différents dans un appareil, vous pouvez mesurer simultanément des peptides de tailles différentes et même des modifications de peptides. « Tout cela signifie qu'un spectromètre de masse polyvalent et bon marché pour l'analyse des peptides est réalisable, " dit Maglia. " Et cela signifierait que davantage de laboratoires pourraient se permettre de mener des études protéomiques très importantes. "