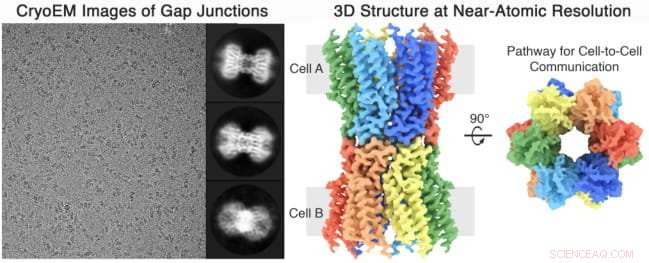
images 2D, la gauche, et la structure 3D, droit, du canal de communication à jonction lacunaire depuis le cristallin, résolu à une résolution proche de l'atome par le Reichow Lab en utilisant la microscopie cryoélectronique Crédit :Reichow Lab | Université d'État de Portland
Des chercheurs de l'Université d'État de Portland ont fait une percée significative en développant la structure 3-D de protéines à l'intérieur du cristallin qui contrôlent la façon dont les cellules communiquent entre elles. qui pourrait ouvrir la porte au traitement de maladies telles que la cataracte, accident vasculaire cérébral et cancer.
L'équipe de recherche PSU, dirigé par le professeur de chimie Steve Reichow, a utilisé un microscope de plusieurs millions de dollars et une nouvelle technique développée par trois biophysiciens lauréats du prix Nobel appelée cryo-microscopie électronique (Cryo-EM) pour visualiser les canaux protéiques membranaires - ou tunnels de transport dans les parois cellulaires - au niveau atomique. Cela a permis à l'équipe de Reichow, dont la recherche est soutenue par les National Institutes of Health, pour créer une image 3-D du canal membranaire afin de mieux comprendre les processus impliqués dans la communication de cellule à cellule.
Des chercheurs de l'État de Portland ont utilisé Cryo-EM, une technique de microscope qui gèle les biomolécules à mi-mouvement et prend des images à ultra haute résolution, et une modélisation informatique pour voir la structure 3D des protéines de jonction lacunaire qui avaient été isolées des lentilles oculaires. Les jonctions lacunaires sont de minuscules canaux qui permettent aux cellules voisines de communiquer entre elles et se trouvent à de nombreux endroits du corps.
Leurs découvertes, publiées le 12 décembre dans la revue scientifique La nature - a montré pour la première fois comment les jonctions communicantes transmettent ou bloquent sélectivement l'information chimique. Jusqu'à maintenant, on ne savait pas comment ces canaux permettraient à certains messages de passer entre les cellules tout en bloquant spécifiquement d'autres.