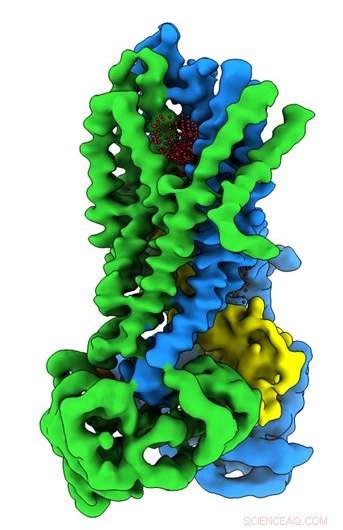
Crédit :Université de Caroline du Nord à la Chapel Hill School of Medicine
Des scientifiques de l'UNC School of Medicine, en collaboration avec des chercheurs de l'Oregon Health &Science University, ont résolu la structure moléculaire tridimensionnelle de la protéine défectueuse chez les personnes atteintes de mucoviscidose à l'état actif et inactif de la protéine. La découverte, publié dans la revue Biochimie , pourrait ouvrir de nouvelles voies de recherche et aider les développeurs de médicaments à créer des pharmacothérapies améliorées pour aider les personnes atteintes de mucoviscidose.
Une grande partie du travail de biochimie a été effectuée dans le laboratoire de John Riordan, Doctorat, professeur distingué de biochimie et de biophysique à l'UNC-Chapel Hill. A la fin des années 1980, Le laboratoire de Riordan a découvert le gène muté responsable de la mucoviscidose. Si un enfant reçoit une copie de ce gène défectueux de chaque parent, l'enfant développera la mucoviscidose. La protéine codée par ce gène a été appelée le régulateur transmembranaire de la mucoviscidose, ou CFTR, qui est le canal chlorure dans les cellules épithéliales qui peuplent le système respiratoire. Les personnes atteintes de mucoviscidose n'ont pas de canal chlorure épithélial fonctionnel, ce qui est essentiel pour maintenir le bon équilibre du sel et de l'eau dans les poumons et d'autres organes. Un résultat de ceci est la production d'épaisses, mucus collant qui devient difficile à évacuer des voies respiratoires, conduisant à des infections chroniques et à une durée de vie plus courte pour la plupart des personnes atteintes de mucoviscidose.
Dans le laboratoire Riordan, stagiaire postdoctoral Jonathan Fay, Doctorat, mené des expériences utilisant la cryomicroscopie électronique à particule unique pour découvrir la structure moléculaire du CFTR en présence d'ATP - un produit chimique organique complexe nécessaire à de nombreux processus dans les cellules, y compris un canal ionique de chlorure de travail crucial pour le bon fonctionnement des poumons. Pour aider à capturer les structures de la protéine CFTR dans son état actif et inactif, le laboratoire Riordan a stabilisé la protéine CFTR de telle sorte que le canal était désactivé lorsqu'il était déphosphorylé et verrouillé lorsqu'il était phosphorylé.
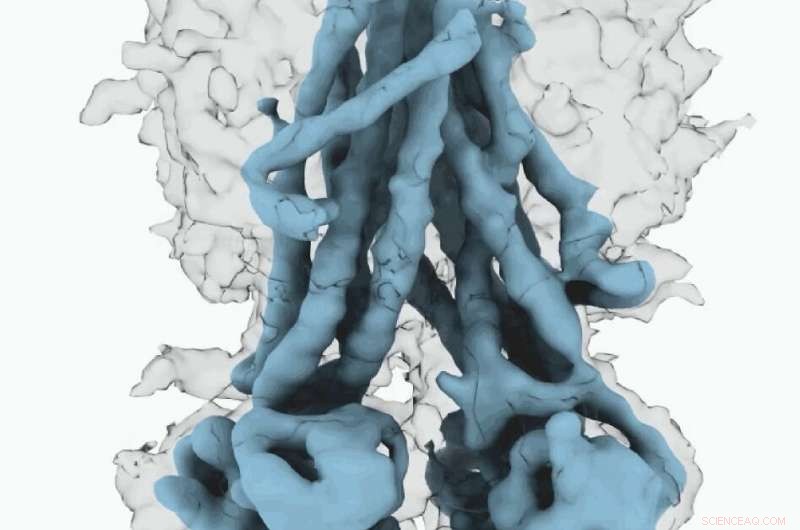
Carte cryo-EM du CFTR. Crédit :Université de Caroline du Nord à la Chapel Hill School of Medicine
Ces structures moléculaires révèlent un repositionnement unique de parties de la protéine CFTR, fournir des informations sur la transition structurelle entre les états fonctionnels actifs et inactifs de CFTR.
De plus, Fay et ses collègues ont observé des détails de ce complexe protéique qui diffèrent de ce que d'autres scientifiques ont découvert dans les structures CFTR précédentes.
« C'est vraiment incroyable de voir à quel point les technologies cryo-EM ont progressé et comment l'utilisation de ces techniques peut nous permettre de visualiser différents états du canal, " Fay a déclaré. "Je pense que nos résultats sont très excitants. Nous avons découvert un nouveau portail qui présente un nouveau domaine prometteur du canal pour cibler et contrôler la fonction du canal CFTR."
Et si les chercheurs peuvent cibler et contrôler avec succès la fonction de ce canal, ils pourraient alors créer des thérapies plus précises pour mieux traiter certaines personnes atteintes de mucoviscidose.