
Fig.1 Production de phénol à l'aide de bactéries. Crédit :Osami Shoji et Masayuki Karasawa
Des chercheurs de l'Université de Nagoya utilisent E.coli pour convertir le benzène en phénol, simplifier une réaction chimique difficile par les méthodes conventionnelles
La rupture des liaisons carbone-hydrogène est notoirement difficile en chimie de laboratoire, pourtant la nature le fait sans effort. Maintenant, les scientifiques ont utilisé des bactéries E.coli pour oxyder les liaisons C-H dans le benzène pour générer du phénol, avec une enzyme génétiquement insérée (cytochrome P450BM3), qui a évolué à l'origine pour cibler d'autres molécules, acides gras à longue chaîne.
Faire en sorte que les enzymes fassent de nouvelles réactions – détourner efficacement la biochimie des cellules vivantes à nos propres fins – est généralement délicat, impliquant des conditions difficiles ou une modification génétique des enzymes elles-mêmes.
Cependant, des chercheurs de l'université de Nagoya ont contourné cela en utilisant des molécules "leurres", qui imitent les cibles natives (substrats) d'enzymes naturelles, pour activer la réaction souhaitée.
Comme indiqué dans Angewandte Chemie Édition Internationale , l'équipe de recherche a créé un composé – surnommé C7-Pro-Phe – à base d'acides aminés. Cette molécule leurre ressemble aux acides gras métabolisés par E.coli. Insérez le leurre dans une cellule E.coli, et il sera mal reconnu comme un acide gras, déclenchant l'activation de l'enzyme P450 insérée. Fournir maintenant du benzène (C6H6), et les bactéries s'affairent, oxydant C6H6 en C6H6O (phénol). Pas besoin du kit de laboratoire habituel - les cellules vivantes peuvent faire de la chimie complexe de manière silencieuse et efficace.
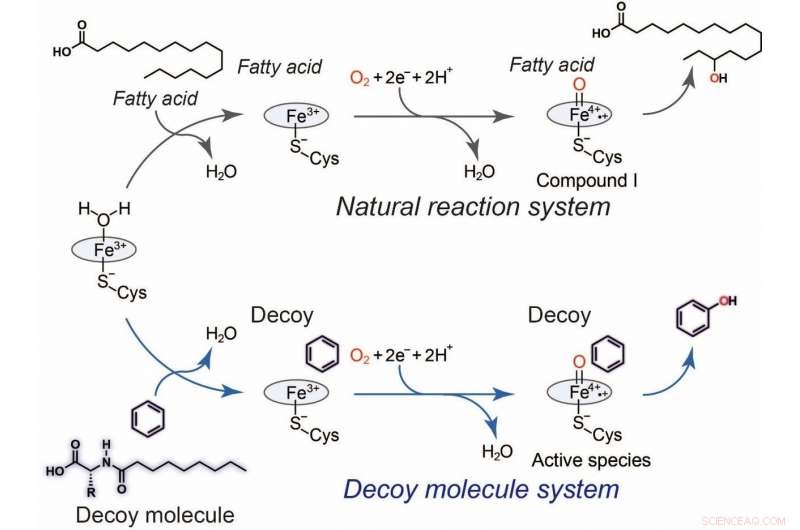
Fig.2 Hydroxylation du benzène à l'aide de molécules leurres. Cycle catalytique général du P450BM3 (noir) et un cycle catalytique plausible (bleu) pour l'hydroxylation du benzène catalysée par le P450BM3 avec l'aide de la molécule leurre. Crédit :Osami Shoji et Masayuki Karasawa
"L'avantage de notre système est que C7-Pro-Phe peut être facilement absorbé par les bactéries, où il active P450BM3 dans la cellule. Cela transforme efficacement chaque bactérie en un biocatalyseur à cellules entières, " étude premier auteur Masayuki Karasawa dit. " La cellule est un cadre optimal pour la réaction biochimique. Les leurres remodèlent en fait le site actif de l'enzyme, nous donnant le contrôle sur les aspects de la réaction, comme la stéréosélectivité."
Tout ce qui est nécessaire est un approvisionnement immédiat en glucose - qui peut être recyclé à partir des déchets - pour nourrir les E. coli.
Parce qu'une variante naturelle - plutôt que génétiquement modifiée - de l'enzyme est exprimée par E. coli, il est probable que d'autres bactéries pourraient également être modifiées avec le même gène pour effectuer ce travail. De plus, différents leurres peuvent convenir à différents substrats ou bactéries. "Un programme combiné de criblage de leurres et de mutagenèse pourrait créer une boîte à outils polyvalente pour les réactions de cellules entières utilisant des bactéries, ", a déclaré le co-auteur Osami Shoji.