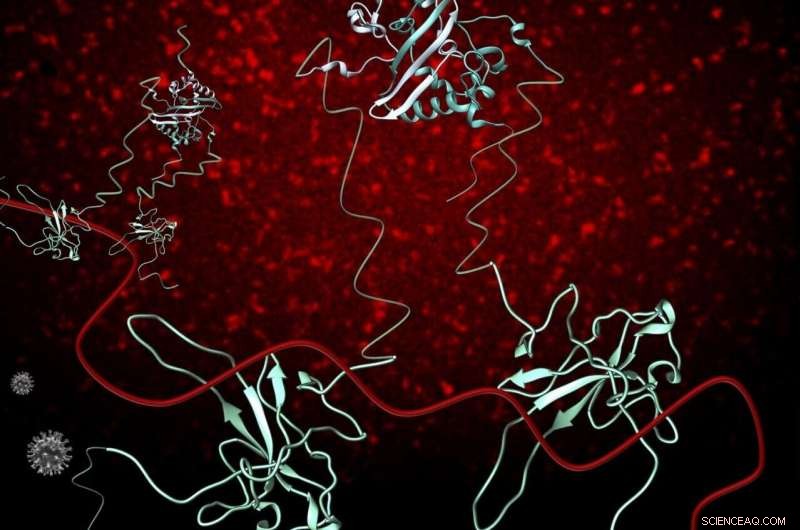
La phosphoprotéine de la nucléocapside (bleue) du SARS-CoV-2 (N) (gris) joue un rôle essentiel dans de multiples processus du cycle d'infection du SARS-CoV-2, y compris la réplication et la transcription, et empaqueter et protéger l'ARN génomique (ARNg) (rouge). La protéine N existe sous forme de dimère en solution et interagit avec l'ARNg principalement via son domaine N-terminal structuré. N se lie à l'ARN de manière polyvalente et à mesure que davantage de protéines N deviennent disponibles, des interactions stabilisatrices entre l'ARN et les protéines se produisent, résultant en une nucléocapside organisée. L'imagerie par fluorescence de 1-1000 ARN avec une étiquette fluorescente Cy3 démontre que l'ARN-Cy3 avec l'ajout de FL-N, s'organise et se condense (fond rouge puncta). Crédit:OSU College of Science
Des chercheurs de l'Oregon State University College of Science ont franchi une étape clé vers de nouveaux médicaments et vaccins pour lutter contre le COVID-19 en approfondissant les interactions d'une protéine avec le matériel génétique du SRAS-CoV-2.
La protéine de la nucléocapside du virus, ou protéine N, est une cible de choix pour les interventions de lutte contre les maladies en raison des tâches essentielles qu'elle effectue pour le cycle d'infection du nouveau coronavirus et parce qu'elle mute à un rythme relativement lent. Les médicaments et les vaccins construits autour du travail de la protéine N ont le potentiel d'être très efficaces et pour de plus longues périodes, c'est-à-dire, moins sensible à la résistance.
Parmi les protéines SARS-CoV-2, la protéine N est le plus grand partenaire de l'ARN viral. L'ARN contient les instructions génétiques que le virus utilise pour obtenir des cellules vivantes, comme les cellules humaines, faire plus d'elle-même, et la protéine N se lie à l'ARN et le protège.
Publié dans Journal biophysique , les résultats sont un point de départ important pour des études supplémentaires sur la protéine N et ses interactions avec l'ARN dans le cadre d'un examen approfondi des mécanismes de l'infection par le SRAS-CoV-2, transmission et contrôle.
Elisar Barber, professeur de biochimie et de biophysique à l'Oregon State, et Ph.D. La candidate Heather Masson-Forsythe a dirigé l'étude avec l'aide des étudiants de premier cycle Joaquin Rodriguez et Seth Pinckney. Les chercheurs ont utilisé une gamme de techniques biophysiques qui mesurent les changements de taille et de forme de la protéine N lorsqu'elle est liée à un fragment d'ARN génomique-1, 000 nucléotides des 30, génome de 000 nucléotides.
"Le génome est assez grand pour un virus et nécessite de nombreuses copies de la protéine N pour coller à l'ARN pour donner au virus la forme sphérique qui est nécessaire pour que le virus fasse plus de copies de lui-même, " a déclaré Barbar. "Notre étude nous aide à quantifier combien de copies de N sont nécessaires et à quel point elles sont proches les unes des autres lorsqu'elles collent à l'ARN. "
Les études biophysiques de N avec de grands segments d'ARN par résonance magnétique nucléaire sont rares, Barbe a dit, en raison de la difficulté de préparer la protéine N partiellement désordonnée et les longs segments d'ARN, à la fois sujettes à l'agrégation et à la dégradation, mais ce genre d'études est une spécialité du laboratoire Barbar. Les études d'autres chercheurs se sont généralement limitées à des morceaux d'ARN beaucoup plus petits et à des morceaux plus petits de la protéine N.
Plutôt que de simplement regarder les régions de liaison à l'ARN de la protéine N seules, le 1, La vue de 000 nucléotides a permis aux scientifiques d'apprendre que la protéine se lie beaucoup plus fortement lorsqu'il s'agit d'un dimère complet (deux copies attachées l'une à l'autre) et d'identifier les régions de la protéine qui sont essentielles à la liaison de l'ARN.
"La protéine complète a des parties structurées mais est en fait très flexible, nous savons donc que cette flexibilité est importante pour la liaison à l'ARN, " a déclaré Masson-Forsythe. "Nous savons également que lorsque les protéines N commencent à se lier à l'ARN plus long, le résultat est une collection diversifiée de complexes protéine/ARN liés par opposition à un seul mode de liaison."
Des médicaments contrecarrant la flexibilité de la protéine N seraient ainsi une piste potentielle pour les chercheurs pharmaceutiques, elle a dit. Une autre possibilité serait des médicaments qui perturbent l'un de ces complexes protéine/ARN qui s'avèrent d'une importance particulière.