
L'imagerie en microscopie électronique révèle la présence de nombreuses vésicules interconnectées, qui semblent se comporter comme des porteurs de collagène (indiqués par des flèches). Crédit: Communications de recherche biochimique et biophysique
Des chercheurs de l'Institut de technologie de Tokyo (Tokyo Tech) ont identifié une enzyme qui contrôle la quantité de collagène sécrétée par les cellules. Comme le déséquilibre du collagène est lié à une gamme de maladies humaines, l'étude fournit des indices sur de nouvelles stratégies thérapeutiques. De plus, les résultats pourraient faciliter la production efficace de collagène pour la nourriture, industries cosmétiques et pharmaceutiques.
Toutes les cellules fabriquent et libèrent des protéines. Les protéines sont emballées sous forme de « cargo » dans de minuscules, vésicules en forme de bulles avant d'être transportées à l'extérieur de la cellule. Ce processus, connu sous le nom de sécrétion, est vital pour une croissance et un développement sains.
Bien que de nombreuses études aient montré comment ces vésicules, appelés porteurs COPII, manipuler des marchandises de taille relativement petite, peu se sont concentrés sur le fonctionnement de transporteurs exceptionnellement gros connus pour emballer de très grosses protéines, comme le collagène.
Maintenant, une étude menée par des chercheurs dont Masayuki Komada, Toshiaki Fukushima et l'étudiant diplômé Kohei Kawaguchi à l'Institut de technologie de Tokyo ont identifié l'USP8 comme une enzyme clé impliquée dans le contrôle de la formation de gros porteurs de collagène. Ils ont rapporté leurs découvertes dans le journal Communications de recherche biochimique et biophysique .
L'équipe a montré que "l'activation" de l'USP8 inhibait la formation de gros porteurs, et donc réduit la sécrétion de collagène. Inversement, désactiver USP8 pour le transport de collagène favorisé, ce qui a entraîné une augmentation de la sécrétion de collagène. (Voir les figures 1-3.)
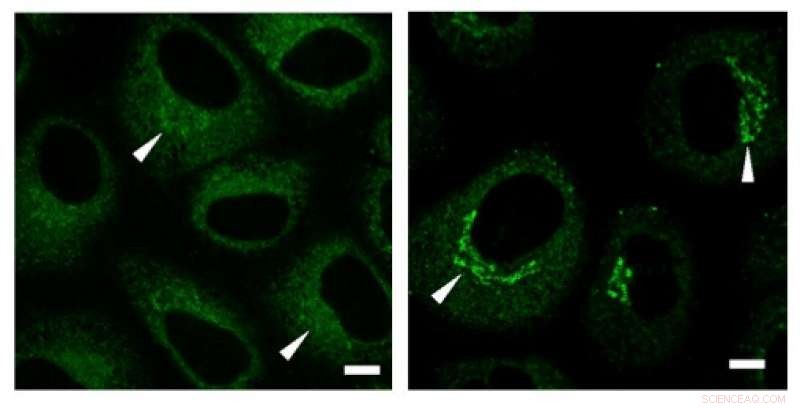
Des expériences d'immunocoloration ont révélé une concentration élevée de collagène (signaux verts) dans la région de Golgi avant la sécrétion. Crédit: Communications de recherche biochimique et biophysique
Les résultats ont de grandes implications pour la médecine et la biotechnologie. Une sécrétion excessive de collagène dans le corps humain est connue pour provoquer une fibrose des organes, alors qu'une sécrétion insuffisante de collagène est associée à des maladies osseuses, notamment la dysplasie cranio-lenticulo-suturale (CLSD) et le syndrome de Cole-Carpenter. De nouveaux traitements pour ces maladies pourraient être développés grâce à une meilleure compréhension du mode d'action exact de l'USP8. Ces connaissances pourraient également fournir de nouvelles façons d'augmenter la production commerciale de collagène.
Les chercheurs ont démontré que l'enzyme fonctionne en désubiquitinant une protéine appelée Sec31A, un composant de la couche de vésicule COPII requis pour l'exportation de protéines.
Un groupe particulier de protéines appelé le complexe USP8-STAM1 semble être responsable de la désubiquitination de Sec31A, comme illustré à la figure 3.
L'étude s'appuie sur de nombreuses années de recherche qui ont mis en lumière la polyvalence de l'USP8.
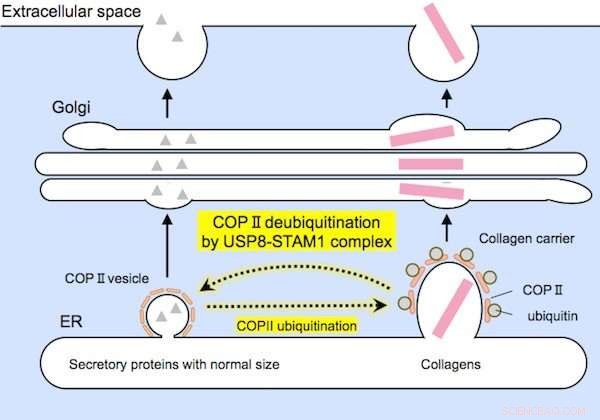
Des protéines de taille relativement petite (à gauche) et des collagènes de grande taille (à droite) sont encapsulés par des supports COPII de tailles appropriées avant la sécrétion. Le complexe USP8-STAM1 inhibe la formation de gros porteurs de collagène. Crédit: Communications de recherche biochimique et biophysique
"Nous avions précédemment signalé que l'USP8 régule la sécrétion d'hormones hypophysaires, " dit Fukushima, se référant à un article publié dans Génétique de la nature en 2015. « Dans le cadre de cette étude, nous avons accidentellement découvert que le complexe USP8-STAM1 se lie à Sec31."
C'était cette découverte "accidentelle", combiné avec des résultats prometteurs d'autres groupes aux États-Unis, qui a conduit l'équipe à examiner le rôle de l'USP8 dans la formation des transporteurs COPII.
Dans des recherches remontant à plus d'une décennie, Komada et d'autres ont clarifié le rôle conventionnel de l'USP8 dans la régulation de l'endocytose5. "Il est très intéressant que le même complexe USP8-STAM1 ait maintenant été montré pour jouer un rôle important à la fois dans la régulation de l'endocytose et dans la sécrétion, " dit Fukushima.
La présente étude révèle donc un « nouveau visage » de l'enzyme USP8, et Fukushima laisse entendre qu'il pourrait y avoir d'autres surprises à venir. USP8 appartient à une famille d'environ 90 enzymes déubiquitinantes connues, qui continuent d'être un sujet brûlant en biologie cellulaire.