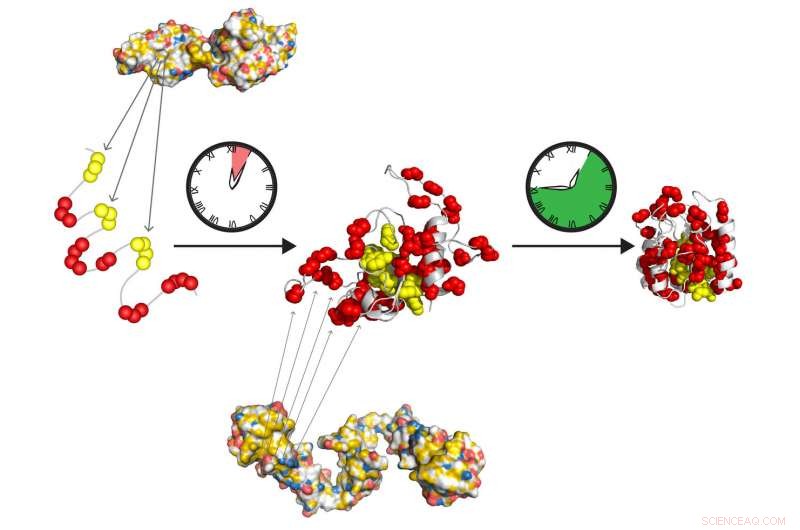
Les chaperons moléculaires Hsp70 et Hsp90 forment une équipe de relais à action rapide pour préparer les protéines à se replier seules dans leur état actif. Hsp70 reconnaît les courts tronçons hydrophobes (jaune), exposés dans la protéine dépliée. Hsp90 agit en aval de Hsp70 et facilite la formation de l'intermédiaire de pliage, qui se transforme lentement en l'état natif, sans autre action de chaperon. Crédit :Tania Morán Luengo et Stefan Rüdiger, Université d'Utrecht
Les protéines cellulaires sont produites sous forme de longues chaînes d'acides aminés qui doivent se replier précisément dans leur forme finale. Les acteurs clés de ce processus de repliement sont les chaperons moléculaires, des aides protéiques qui assurent le succès de ce processus. Chercheurs de l'Université d'Utrecht, en étroite collaboration avec des collègues de l'Université de Heidelberg, ont enfin découvert comment les deux familles de chaperons les plus importantes, Hsp70 et Hsp90, coopérer dans ce processus de pliage. Étonnamment, il s'avère qu'ils n'aident pas activement au pliage, comme les scientifiques l'avaient longtemps supposé. Au lieu, ils préparent simplement les protéines pour la spontanéité, pliage productif. Cette avancée dans la compréhension du fonctionnement de la cascade Hsp70-Hsp90 sera publiée dans Cellule moléculaire le 3 mai.
Des protéines mal repliées peuvent entraîner des maladies graves telles que la mucoviscidose et de nombreuses maladies neurodégénératives comme la maladie d'Alzheimer. Les scientifiques savent depuis longtemps que Hsp70 et Hsp90 jouent un rôle clé dans ce processus de pliage, et que Hsp90 agit en aval de Hsp70. Cependant, le mécanisme réel par lequel ils replient une protéine est resté énigmatique.
doctorat la candidate Tania Morán Luengo de l'Université d'Utrecht a récemment démontré que le chaperon Hsp70 se lie à la jeune protéine, le protégeant tout en l'empêchant de se plier. Ensuite, Hsp90 casse le bloc Hsp70, ce qui permet à la protéine de continuer à se replier dans l'état correct toute seule. Cette découverte a marqué la fin surprenante de la croyance de longue date selon laquelle les chaperons replient les protéines.
Le directeur de la recherche, le Dr Stefan Rüdiger de l'Université d'Utrecht, a eu un aperçu de cette nouvelle idée alors qu'il se préparait à donner un cours sur le sujet. Hsp70 se lie aux acides aminés hydrophobes, les protégeant de coller ensemble jusqu'à ce qu'ils soient cachés à l'intérieur de la structure finale de la protéine. Il s'est rendu compte que la façon dont Hsp70 se lie à ses substrats ne pouvait donc pas contribuer au repliement des protéines, mais plutôt l'inhibe à la place.
Les chercheurs ont alors entrepris d'analyser le processus de pliage, observant que des concentrations de Hsp70 dans la gamme de celles présentes dans nos cellules inhibaient le repliement des protéines. "Cela a déduit que Hsp70 n'est pas un promoteur, mais en fait un inhibiteur efficace du processus de pliage, " explique Rüdiger. Son groupe s'est associé au laboratoire du professeur Matthias Mayer de l'Université de Heidelberg pour tester cette hypothèse expérimentalement. Ils ont démontré que la présence de Hsp90 à ce stade est critique pour le processus de repliement. Hsp90 permet à la protéine de se casser de l'impasse Hsp70 pour se replier tout seul dans sa bonne forme.
Molecular Cell a choisi une illustration de cette recherche pour sa couverture. L'œuvre a été réalisée par le responsable de la recherche Stefan Rüdiger (acrylique sur toile). Il représente que les chaperons Hsp70 et Hsp90 conservés forment une cascade qui n'est active que dans le premier, minutes brûlantes du processus de pliage. Le passage ultérieur à travers la piste vers l'état natif est long et lent - et sans interférence par les chaperons. Crédit :Cellule moléculaire / Stefan Rüdiger, Université d'Utrecht
"Ce mécanisme d'arrêt-démarrage est conservé de la bactérie à l'homme, " dit Rüdiger. " De nombreuses maladies dépendent de la forme active finale des protéines. Ainsi, les chercheurs travaillant sur des thérapies ciblant le processus de pliage savent enfin quoi chercher. »