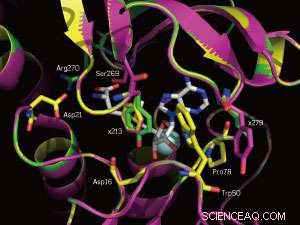
Gros plan sur les sites de liaison SAM de l'enzyme native (jaune) et de deux mutants (magenta et vert). Les positions mutées 213 et 279 sont marquées. Crédit :WILEY-VCH Verlag GmbH &Co. KGaA, Weinheim
Les molécules organiques contenant un atome de fluor sont largement utilisées dans les matériaux, industries agrochimiques et pharmaceutiques. Cependant, la synthèse de la liaison carbone-fluor utilise généralement des catalyseurs métalliques toxiques et nécessite des conditions anhydres et des températures élevées. Maintenant, une équipe internationale a développé un plus doux, approche enzymatique plus efficace pour créer cette liaison.
Cette méthode enzymatique fonctionne dans des conditions aqueuses et à des températures douces et a été développée par un consortium comprenant des chercheurs d'A*STAR et d'autres institutions. « Ces conditions sont vraiment très attractives, " explique Yee Hwee Lim, membre de l'équipe de l'A*STAR Institute of Chemical and Engineering Sciences.
L'équipe a utilisé l'une des enzymes fluorinases hautement spécifiques que l'on trouve dans la nature, la FlA1. Ces enzymes catalysent la formation d'une liaison carbone-fluor dans la S-adénosylméthionine (SAM) en utilisant du fluorure inorganique via un mécanisme de substitution.
L'enzyme, tout en étant excellent pour catalyser les réactions de fluoration avec cette molécule naturelle, n'a pas bien fonctionné sur des molécules non naturelles. De plus, efforts pour modifier les structures des enzymes et, Donc, fonction avait été une lutte – jusqu'à maintenant.
"Nous avons montré pour la première fois que l'enzyme fluorinase peut être modifiée, et que l'ingénierie peut améliorer son activité enzymatique même sur des molécules non naturelles, " dit Lim.
L'équipe a utilisé la technique établie connue sous le nom d'« évolution dirigée », qui imite la sélection naturelle pour faire évoluer les enzymes afin qu'elles puissent bien réagir avec des molécules non naturelles.
"L'évolution dirigée n'a jamais été appliquée avec succès à cette enzyme, jusqu'à maintenant, " dit Lim. " Il s'agit d'une enzyme difficile à travailler et nous avons été confrontés à de nombreux défis, notamment des problèmes de dégradation du produit. "
L'équipe a utilisé le radiomarquage de la 5'-chloro-5'-désoxyadénosine (5'-CIDA) pour mettre en valeur ses capacités. Dans cette réaction en deux étapes, le 5'-CIDA radiomarqué est converti en SAM, puis fluoré pour former la 5'-fluoro-5'-désoxyadénosine (5'-FDA). Ce produit marqué 5'-FDA pourrait potentiellement être utilisé pour une procédure de diagnostic médical connue sous le nom de tomographie par émission de positons (TEP).
"Nous montrons que le triplement de l'activité d'une enzyme peut ouvrir davantage d'applications, " dit Lim. " Les enzymes natives ont été utilisées auparavant pour essayer d'étiqueter les agents PET, mais les temps de réaction étaient longs, parfois des heures. En utilisant notre enzyme, nous pourrions faire la réaction en 30 minutes, un délai plus raisonnable étant donné que la demi-vie du Fluor-18 est inférieure à deux heures."
L'équipe de Lim explore maintenant comment la mutation de la structure de l'enzyme modifie son interaction avec le 5'-CIDA et SAM. "J'aimerais engager des biologistes computationnels pour mieux comprendre les mutations que nous avons faites et comment celles-ci sont en corrélation avec nos réactions."