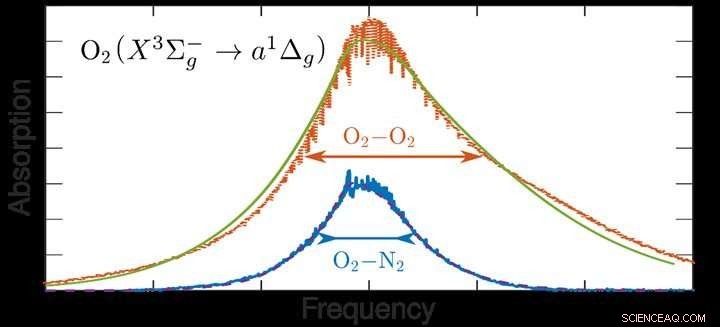
Figure :Spectres expérimentaux et théoriques d'absorption lumineuse due à la collision de molécules d'oxygène (O2) avec d'autres molécules d'oxygène et avec des molécules d'azote (N2). Comme montré ici, l'absorption due aux collisions O2 -O2 est beaucoup plus forte que celle due aux collisions O2-N2 et la ligne est beaucoup plus large que dans le premier cas. Crédit :Université Radboud
Les scientifiques de l'Université Radboud ont réussi à faire ce qui n'avait jamais été essayé auparavant :décrire avec précision comment les molécules d'oxygène en collision absorbent la lumière. Notre atmosphère se compose d'environ 20 pour cent de molécules d'oxygène, qui entrent constamment en collision les unes avec les autres et avec les 80 pour cent de molécules d'azote, et ce faisant, absorbe la lumière. La nouvelle théorie décrit le mécanisme par lequel cela se produit. Cette découverte permettra aux climatologues de déterminer avec beaucoup plus de précision les concentrations des molécules qui polluent l'atmosphère et contribuent à l'effet de serre.
A l'aide de satellites dans l'espace, nous sommes en mesure de mesurer avec précision les principaux polluants et gaz à effet de serre dans l'atmosphère. Afin de le faire, les satellites observent le spectre de la lumière solaire qui traverse l'atmosphère. Les molécules de divers gaz atmosphériques absorbent la lumière du soleil, et cette absorption se produit à des longueurs d'onde différentes pour chaque gaz. Puisque l'« empreinte digitale » (le spectre) de chacun des différents gaz est connue, les scientifiques en savent désormais plus sur la présence et la concentration de chacun de ces gaz.
Pour corriger ces mesures des effets des nuages et des changements de pression atmosphérique, l'absorption par l'oxygène est mesurée comme référence, parce que nous savons exactement combien d'oxygène est présent dans l'atmosphère. Des scientifiques de l'Université Radboud montrent maintenant que l'« empreinte digitale » de l'oxygène est différente de ce qu'on croyait, car il est fortement influencé par les collisions avec l'azote et les collisions avec d'autres molécules d'oxygène.
Absorption de la lumière due à la collision
Oxygène, sous forme de molécules d'O2, est, après l'azote (N2), le gaz le plus répandu dans l'atmosphère. Les molécules stables ne sont presque jamais magnétiques, mais l'oxygène l'est. Lorsqu'une molécule d'oxygène ou d'azote entre en collision avec une autre particule, il y a un déplacement des charges électriques dans la molécule. Un dipôle est créé qui fonctionne comme une antenne, permettant à la molécule d'absorber la lumière. La théorie qui vient d'être développée montre que, contrairement aux attentes, l'effet des collisions de l'oxygène avec d'autres molécules d'oxygène est très différent de l'effet des collisions avec les molécules d'azote. Il est montré que la raison de cette différence est que l'oxygène est magnétique alors que l'azote ne l'est pas.
Mesure de l'absorption
Les scientifiques ont d'abord examiné cela avec une expérience :dans un réservoir avec de l'oxygène gazeux, ils ont mesuré le spectre d'absorption de la lumière par les molécules d'oxygène à différentes pressions. Si la pression augmente, les molécules entrent en collision plus fréquemment les unes avec les autres, ce qui entraîne une plus grande absorption de la lumière, mais aussi la forme du spectre d'absorption change. Pour comprendre cela, les scientifiques ont développé une nouvelle théorie compliquée pour l'absorption de la lumière par collision de molécules d'oxygène. A l'aide de cette théorie, les mesures satellites de l'atmosphère peuvent être interprétées avec plus de précision.
Cela semblait impossible…
Il n'était en aucun cas certain que le développement d'un bon modèle d'absorption de la lumière par collision de molécules d'oxygène serait un succès. Professeur de chimie théorique Gerrit Groenenboom :« Certains scientifiques ont dit que nous ne serions jamais capables de le faire. Et quand nous avons commencé, il semblait qu'aucune méthode ne pouvait fournir de résultats fiables. Finalement, avec l'utilisation d'une méthode nouvellement développée, nous avons réussi à montrer que, malgré une certaine incertitude, la forme du spectre peut être prédite avec précision. » Il a également été montré que cette forme peut être décrite avec une fonction analytique, ce qui est pratique pour les applications futures.
Même expérience, résultat différent
Les astronomes ont également été aidés par les découvertes des scientifiques. Les scientifiques qui examinent l'atmosphère utilisent la base de données HITRAN du Harvard-Smithsonian Center for Astrophysics, qui contient les spectres d'une grande collection de molécules. Cependant, les mesures du spectre de l'oxygène par deux groupes de recherche différents ont fourni des résultats très différents. Il n'était pas clair lequel des résultats était suffisamment fiable pour être inclus dans la base de données. Ce problème a pu être résolu à l'aide du modèle théorique développé à Nimègue :la forme de ligne résultant d'une des deux mesures s'est avérée fondamentalement différente de la théorie.
Cela ne signifie pas que l'expérience elle-même était incorrecte, mais plutôt son interprétation. Chercheur Tijs Karman :« Les astronomes utilisent également cette base de données pour interpréter les spectres de l'atmosphère des exoplanètes et, par exemple, pour voir s'il y a de l'oxygène, qui est considéré comme un signe de vie."