Cible protéique Crédit :Elena Khavina/MIPT
Des chercheurs du MIPT et de plusieurs universités américaines et chinoises ont résolu la structure de l'une des protéines du système nerveux les plus importantes en complexe avec un certain nombre de molécules médicamenteuses. La découverte ouvre des opportunités pour développer de nouveaux médicaments avec une action régulée et moins d'effets secondaires. L'article a été publié dans la revue Cellule .
De nombreux médicaments modernes ciblent les protéines car elles sont responsables de la plupart des réactions physiques et chimiques dans une cellule. Les molécules de protéines permettent également aux cellules de communiquer en transmettant des signaux entre elles. Lorsqu'une personne tombe malade, l'harmonie dans les cellules est perturbée, ainsi, les médicaments sont utilisés pour rétablir l'équilibre en augmentant ou en réduisant temporairement l'activité des protéines. Beaucoup d'entre eux remplissent des fonctions similaires et ont des structures presque identiques, ce qui signifie qu'un médicament peut affecter plusieurs types de protéines. Cette capacité des médicaments à interagir avec plusieurs cibles protéiques est appelée polypharmacologie.
Lorsque l'approche moléculaire du développement de médicaments a été introduite pour la première fois, une notion générale parmi les pharmacologues était que l'efficacité d'un médicament dépendait de la façon dont un médicament particulier interagissait avec une protéine donnée. L'interaction avec d'autres types de protéines, cependant, a été pensé pour provoquer uniquement des effets secondaires indésirables. Alors à l'époque, l'objectif principal de la pharmacologie était de maximiser la sélectivité, c'est-à-dire la capacité d'un médicament à cibler uniquement un type spécifique de protéines. Le concept a reçu un nom métaphorique du lauréat du prix Nobel Paul Ehrlich qui a inventé le terme « balles magiques » pour désigner des médicaments aussi hautement sélectifs.
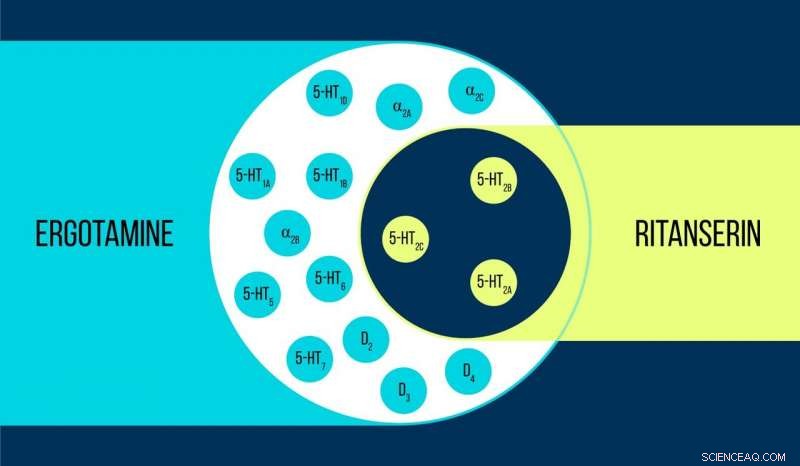
Comparaison de l'ergotamine et de la ritansérine Crédit :Elena Khavina/MIPT
Cependant, comme cela arrive souvent, le concept le plus simple n'est pas nécessairement le plus réussi. Les progrès des technologies informatiques en chimie et en biologie ont permis de produire des médicaments extrêmement sélectifs qui n'agissaient que sur deux ou trois sous-types proches d'une protéine cible. Mais ils n'étaient pas aussi efficaces que leurs analogues à faible sélectivité dans le traitement de troubles complexes tels que la dépression :les profils polypharmacologiques de certains médicaments se sont avérés importants pour leurs effets bénéfiques. Il s'est avéré que la polypharmacologie ne provoque pas nécessairement d'effets secondaires indésirables, pourtant, il est important de contrôler quelles protéines sont affectées. La notion de "balle magique" a ainsi été remplacée par la notion de "fusil magique", qui met l'accent sur les médicaments ayant un effet souhaité sur une combinaison particulière de cibles.
Le but de cette recherche était d'identifier les caractéristiques structurelles des protéines qui expliqueraient pourquoi certains médicaments agissent sur elles de manière sélective et d'autres non. Pour réaliser l'étude, les scientifiques ont utilisé le récepteur de la sérotonine 5-HT2c, une protéine de signalisation située dans la membrane cellulaire, qui est activé par la sérotonine pour recevoir des signaux des cellules voisines. Le récepteur a un certain nombre de caractéristiques importantes. D'abord, il est déjà utilisé comme cible validée pour les médicaments anti-obésité, tout en étant une cible thérapeutique potentielle pour plusieurs troubles mentaux. Seconde, il est ciblé par un certain nombre de médicaments avec un large éventail de sélectivités, permettant de les comparer. Troisièmement, un corps humain possède plus de 800 autres récepteurs dont la structure est similaire à celle du 5-HT2c mais qui remplissent des fonctions différentes. C'est pourquoi ses antagonistes non sélectifs ont souvent une multitude d'effets secondaires.
Vsevolod Katritch, professeur invité au MIPT, dit, « Nous avons utilisé deux produits chimiques pour travailler avec le récepteur de la sérotonine 5-HT2c :l'ergotamine et la ritansérine. L'ergotamine est un agoniste non sélectif avec un large profil polypharmacologique :elle influence la sérotonine, dopamine, et les récepteurs adrénergiques. Ritansérine, par contre, a un profil plus étroit [figure 1] et est l'agoniste inverse sélectif des récepteurs 5-HT2c. Ainsi, les structures atomiques 5-HT2c obtenues en complexe avec l'ergotamine et la ritansérine aident non seulement à expliquer les différences entre les états des récepteurs actifs et inactifs - ce qui est en soi une réalisation considérable - mais aussi à découvrir les raisons d'une telle sélectivité moléculaire.
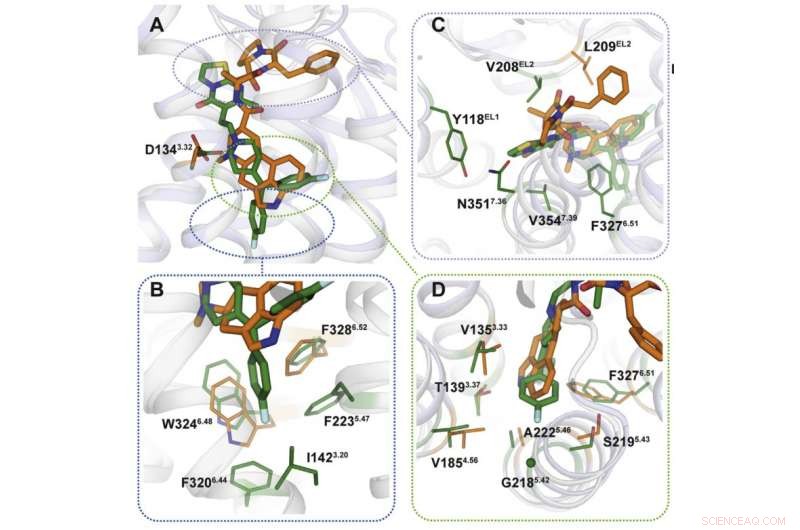
Crédit :Institut de physique et de technologie de Moscou
En utilisant la cristallographie aux rayons X, les scientifiques ont obtenu un modèle 3-D des protéines au moment de leur interaction avec les médicaments. De manière prévisible, les mécanismes de liaison des médicaments étaient différents (figure 2). Les sites de liaison ciblés par l'ergotamine se ressemblent dans de nombreuses protéines, ce qui explique la non sélectivité du produit chimique. Ritansérine, d'autre part, interagit différemment avec le récepteur et n'agit que sur certains de ses fragments qui sont propres à un petit groupe de protéines. Présentation de plusieurs mutations qui transforment ces fragments en gène du récepteur 5HT2c, les chercheurs ont remarqué que l'interaction avec la ritansérine est devenue moins efficace, ce qui a confirmé que ces zones protéiques sont celles qui sont responsables de la sélectivité du produit chimique.
Petr Popov, chercheur au Laboratoire de Biologie Structurale des Récepteurs Couplés aux Protéines G du MIPT, dit, « Le principal défi dans l'identification des structures réceptrices était d'obtenir un construction génétiquement modifiée qui conviendrait à la cristallisation et avec laquelle nous pourrions travailler et étudier. En utilisant l'approche bioinformatique et les méthodes d'apprentissage automatique, nous avons identifié des mutations ponctuelles stabilisatrices pour le récepteur 5HT2c à la fois dans ses états actif et inactif."
Ainsi, l'analyse des caractéristiques structurelles des protéines en complexe avec des médicaments de sélectivité variable s'est avérée efficace. Il permet de contrôler l'ensemble des cibles et donc à la fois les effets directs et secondaires d'un médicament au cours de son développement. Aussi, ces médicaments bénéficieront à de nombreux patients grâce à des profils thérapeutiques améliorés qui combattent une variété de maladies et ont moins d'effets secondaires.