justification de la conception de la FESS, la mise en oeuvre, et candidature. (A) Schéma de la voie de livraison d'informations sur les biomarqueurs activée par la FESS, illustrant l'échantillonnage, sentir, et l'acheminement des informations de biomarqueur récupérées par voie épidermique vers l'électronique de lecture via une seule entité. (B) Justification de la conception de la FESS. (C) Mise en œuvre représentative de la FESS, démontrant la flexibilité et l'absence d'interconnexion dans le plan. (D) Famille représentative d'appareils FESS, contenant 1 × 2, 3 × 3, et 6 × 6 réseaux d'électrodes. (E) Smartwatch développée sur mesure et compatible FESS pour la surveillance des biomarqueurs. (F et G) Déploiement de la montre connectée compatible FESS dans des environnements d'exercices stationnaires (F) et de haute intensité (G). (Crédit photo :Peterson Nguyen, Kaili Chiu, Yichao Zhao, Université de Californie, Los Angeles.) Crédit : Avancées scientifiques , doi:10.1126/sciadv.aaz0007
Dans une nouvelle étude publiée le Avancées scientifiques , Yichao Zhao et une équipe de recherche en bioélectronique intégrée, en matériaux et en ingénierie aux États-Unis ont conçu un produit jetable, système de détection électrochimique autonome (FESS). Le FESS leur a permis de réaliser une stratégie de conception au niveau du système pour relever les défis des biocapteurs portables en présence de mouvement et permettre une intégration transparente avec l'électronique grand public. L'équipe a développé une montre connectée compatible FESS, avec prélèvement de sueur, détection électrochimique et affichage ou transmission de données, dans une plate-forme portable autonome. L'équipe a utilisé la FESS-smartwatch pour surveiller les profils des métabolites de la sueur chez les individus en situation d'exercice sédentaire et à haute intensité.
L'infrastructure de l'Internet des objets (IOT) peut être utilisée dans l'électronique grand public portable pour transformer la médecine personnalisée et de précision en récoltant des données physiologiquement pertinentes avec une intervention minimale de l'utilisateur. Les scientifiques ont généralement utilisé des capteurs physiques dans des plates-formes portables commerciales pour suivre l'activité physique et les signes vitaux d'un utilisateur. Cependant, pour mieux comprendre la chimie dynamique du corps, les chercheurs ont besoin de surfaces de détection électrochimiques pour cibler les molécules biomarqueurs dans les fluides corporels récupérés de manière non invasive, tels que la sueur. Pour y parvenir, il est essentiel de concevoir avec précision la voie de transmission des informations de la peau à une unité de lecture. Pour la détection électrochimique, la voie de délivrance d'informations doit échantillonner et délivrer le biofluide riche en biomarqueurs à la surface du capteur dans une structure microfluidique, suivi de la transduction du signal à travers des éléments interconnectés jusqu'à l'électronique de lecture. Le signal doit être maintenu le long de cette voie en présence d'une contrainte induite par le mouvement.
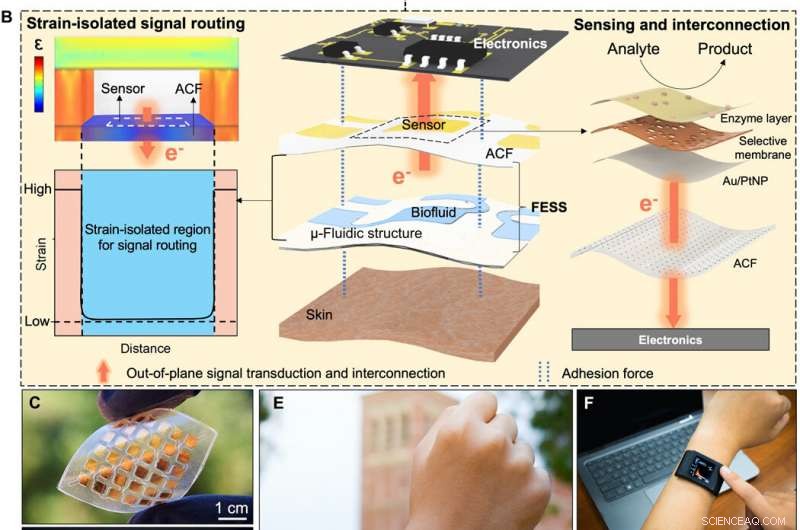
Détection in situ bio-inspirée et interconnexion de signaux. (A) Illustration conceptuelle de l'échange d'informations physiologiques entre matrices intracellulaires/extracellulaires facilité par les molécules adhésives cellulaires (intégrine) via la détection, interconnexion de signaux hors plan, et adhérence double face. (B) Détection in situ, interconnexion de signaux hors plan, et l'adhérence double face permise par FESS, en tant qu'entité unique, placé entre la peau et l'électronique. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aaz0007
Dans ce travail, Zhao et al. a développé le système de détection électrochimique autonome (FESS) et l'a fait adhérer simultanément à la peau et à l'électronique en utilisant des forces d'adhérence double face sans connecteurs rigides. Le FESS a échantillonné et dirigé des biofluides extraits de l'épiderme pour la détection électrochimique, suivi du routage vers l'électronique de lecture via une voie isolée des contraintes. Ils ont intégré le FESS dans une montre intelligente sur mesure pour l'induction de la sueur, échantillonnage, détection électrochimique, traitement du signal et affichage ou transmission de données. Les résultats ont montré une transduction de signal haute fidélité et un contact mécanique robuste avec la peau humaine sans restreindre le mouvement de l'utilisateur. Le système de détection autonome peut être lié à de futurs appareils électroniques portables pour générer des ensembles de données haute fidélité liés à la santé et au bien-être en fonction des activités quotidiennes des utilisateurs.
Pour créer une voie biologique efficace, Zhao et al. l'intégrine sélectionnée, une molécule adhésive cellulaire qui a permis efficacement l'échange d'informations physiologiques entre les matrices intracellulaires et extracellulaires. Le dispositif FESS a mis en œuvre des fonctionnalités de type intégrine à travers une région isolée de la contrainte dans une structure microfluidique. Ils ont conçu FESS comme un conducteur vertical, adhésif double face et système de film mince bioanalytique microfluidique flexible composé de plusieurs films empilés verticalement. Ces films comprenaient un film conducteur anisotrope adhésif (ACF), un film de réseau d'électrodes en métal noble, un film biochimique, un film microfluidique et un film adhésif cutané. Ils ont collé le système de film mince complet sur l'électronique de lecture sans connecteurs et avec une résistance de contact minimale pour potentiellement transformer tout contact électrique en un capteur chimique ou biologique. L'équipe a développé une preuve de principe, Smartwatch autonome à détection de biomarqueurs avec FESS pour surveiller les profils des métabolites de la sueur des individus dans des environnements sédentaires ou à haut niveau d'exercice.

Simulation de contrainte FESS et caractérisation de l'interconnexion de signaux isolés en contrainte. (A) Illustration de l'interconnexion du signal hors plan du FESS par rapport à l'interconnexion du signal dans le plan conventionnel. Les implémentations conventionnelles sont limitées au routage du signal à travers des régions très sollicitées, tandis que le FESS conçu permet le routage via des régions de contrainte proches de zéro. (B) Profil de déformation (ε) simulé par COMSOL d'un FESS représentatif en présence d'une force de cisaillement appliquée de l'extérieur, illustrant une contrainte proche de zéro au fond du microcanal (c'est-à-dire, interface substrat-biofluide). (C) Vue agrandie correspondante du profil de déformation pour un « pixel ». (D) Répartition des souches le long de la ligne pointillée en (C). (E) Caractérisation électrique de l'interconnexion hors plan de FESS réalisée sous différents angles de flexion localisés (pour un réseau d'électrodes 6 × 6 Au). (F) Résistances d'interconnexion du FESS-FPCB coudé (RFESS + RFPCB), pour différents angles de pliage localisés (normalisés par rapport au RFPCB sans pliage, RFPCB, 0). Les barres d'erreur indiquent l'erreur standard des mesures sur les six électrodes dans chaque colonne. (G) Mesures de résistance des électrodes FESS sous différents angles de flexion (n =36), par rapport à la résistance de la plage de contact FPCB (RFPCB, 0). (H à J) Tests de pelage à 180° caractérisant l'adhésion d'interconnexion entre le PCB et le FESS avec différentes structures de support :base microfluidique – ACF (H), canal microfluidique–ACF (I), et un réseau de canaux microfluidiques représentatif – ACF (J). (Crédit photo :Peterson Nguyen, Université de Californie, Los Angeles.) Crédit : Avancées scientifiques , doi:10.1126/sciadv.aaz0007
Dans cette configuration, la conductivité verticale de l'ACF a facilité les interconnexions de signaux hors du plan pour éviter les effets de contrainte induits par les mouvements corporels indésirables sur les voies du signal. L'équipe a caractérisé la propriété d'adhérence mécanique du FESS pour s'assurer que les forces d'adhérence entre le FESS et l'électronique étaient plus élevées que celles entre le FESS et la peau sèche ou en transpiration active. L'équipe a testé la force nécessaire pour décoller la couche ACF du FESS sur une carte de circuit imprimé et les résultats ont montré une forte interconnexion basée sur FESS avec l'électronique, comme adapté aux applications sur le corps.
Zhao et al. puis testé la capacité de transduction du signal du FESS. Ils ont modelé des électrodes en métal noble sur l'ACF pour réaliser une transduction de signal biochimique à électrique, suivi d'un dépôt de films biochimiques pour analyser les cibles biomoléculaires d'intérêt. Ils ont testé l'activité électrochimique de l'ACF à motifs métalliques pour deux surfaces d'électrodes couramment utilisées sur de l'or non modifié (Au) et du platine (Pt) modifié par des nanoparticules Au. Les méthodes électroanalytiques étudiées dans le travail ont fourni des lectures de biomarqueurs échantillon-réponse pour obtenir un aperçu en temps réel des altérations de la biocomposition de la sueur.

Test de la mesure de résistance des interconnexions à base d'ACF après déformation mécanique. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aaz0007
Dans les prochaines expériences, l'équipe de recherche a montré la capacité de FESS à surveiller les biomarqueurs au cours des activités quotidiennes de l'utilisateur. Pour y parvenir, ils ont intégré FESS dans une montre intelligente développée sur mesure en tant que modèle de dispositif IOT contenant un circuit analogique/numérique, Émetteur-récepteur Bluetooth et écran à cristaux liquides (LCD) pour les fonctionnalités au niveau du système, y compris le traitement du signal et de la commande utilisateur, affichage et communication de données sans fil. La montre connectée basée sur FESS fonctionnait de la même manière qu'un potentiostat. Les scientifiques ont collé la montre intelligente complète sur la peau sans emballages externes ni accessoires pour la détection de biomarqueurs sans fil en tant qu'unité autonome. L'écran LCD affiche les lectures en temps réel et le profil temporel des mesures des biomarqueurs, tandis que le récepteur Bluetooth a relayé les lectures vers une application mobile développée sur mesure pour télécharger les données sur un serveur cloud pour une analyse plus approfondie.
L'équipe a collé la montre intelligente basée sur FESS sur l'avant-bras d'un sujet pour afficher sa fonction en tant que système portable pour surveiller les biomarqueurs. Le sujet pourrait contrôler sans fil l'appareil pour prendre en temps réel, mesures de biomarqueurs basées sur la sueur par rapport à la routine quotidienne de l'utilisateur. L'utilisateur a surveillé ses niveaux de glucose dans la sueur avant ou après avoir consommé une gamme mixte de repas et la lecture de la montre intelligente a indiqué des niveaux de glucose dans la sueur élevés après la prise de nourriture, en accord avec les tendances précédentes. La smartwatch a également fourni à l'utilisateur des informations sur les lectures de lactate de sueur lors d'une course dans un champ, les résultats étaient cohérents malgré l'implication de mouvements corporels à haute fréquence et à forte accélération.
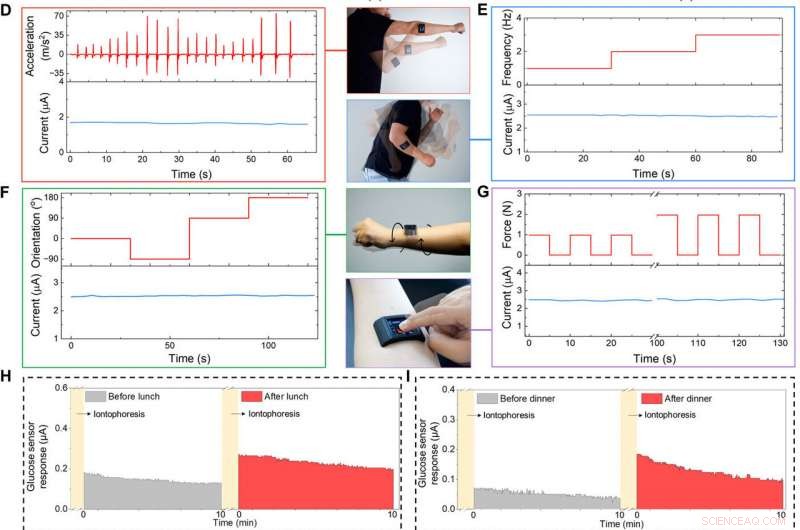
Montre intelligente intégrée à FESS développée sur mesure pour une application sur le corps. (A) Illustration de la montre connectée compatible FESS (contenant FESS, Écran LCD, PCB, et des unités de batterie logées dans un boîtier imprimé en 3D). (B et C) Caractérisation ex situ de la réponse du système de détection du glucose FESS-PCB lors d'une vibration vorticale (électrode FESS :6 mm2, hauteur du canal microfluidique :170 m, et volume :4 µl). Les profils d'accélération vibrationnelle sont présentés dans la moitié supérieure, et les réponses du capteur sont capturées dans la moitié inférieure lorsqu'elles sont testées dans du PBS (B) et 100 M de glucose dans du PBS (C). (D à G) Caractérisation de la fidélité du signal sur le corps d'un système de détection de lactate FESS-PCB avec un sujet réalisant du shadow boxing (D), balancement des bras (E), torsion du poignet (F), et dispositif en appuyant sur (G). L'accélération, la fréquence, orientation, et les profils de force sont présentés dans la moitié supérieure, et les réponses des capteurs sont capturées dans la moitié inférieure. (H à J) Suivi des profils de métabolites des sujets à travers divers événements quotidiens et dans différents contextes. La glycémie induite par iontophorèse a été mesurée avant et après le déjeuner (H) et le dîner (I). (J) Mesures de lactate de sueur pendant l'exercice (un profil d'accélération induit par le mouvement représentatif est illustré à droite). (Crédit photo :Peterson Nguyen, Kaili Chiu, et Yichao Zhao, Université de Californie, Los Angeles.) Crédit : Avancées scientifiques , doi:10.1126/sciadv.aaz0007
De cette façon, Yichao Zhao et ses collègues ont examiné la voie de transmission des informations sur les biomarqueurs et reconnu les régions tendues proches de zéro à l'intérieur d'un module de détection microfluidique pour concevoir un chemin isolé de la souche afin de préserver la fidélité des données des biomarqueurs. Le système à couche mince qui a formé l'entité FESS autonome a été bioinspiré par des fonctionnalités de type intégrine pour la transduction et l'interconnexion de signaux via une adhésion double face. Le FESS a efficacement ponté la peau et l'électronique de lecture pour récolter des informations sur les biomarqueurs. L'équipe a couplé le système FESS de manière transparente avec une montre intelligente développée sur mesure en tant que biocapteur portable pour surveiller les lectures de biomarqueurs en temps réel tout au long de la routine quotidienne d'un utilisateur. Pour commercialiser le prototype développé dans ce travail, Zhao et al. proposer de futurs essais cliniques pour cartographier les lectures de biomarqueurs basés sur la sueur et obtenir des informations sur l'état physiologique des utilisateurs. Les avantages de ce travail, y compris leur facilité d'intégration avec l'électronique portable et les lectures haute fidélité peuvent être utilisées pour effectuer des investigations cliniques à grande échelle.
© 2020 Réseau Science X