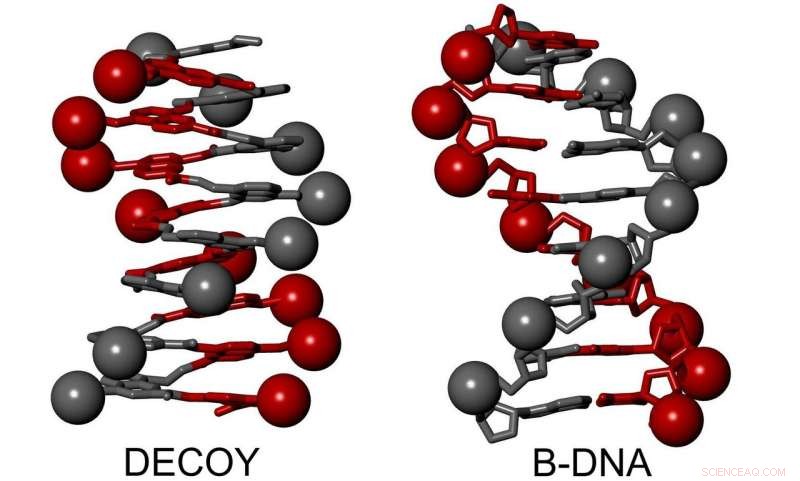
Représentations d'une double hélice d'ADN-B et d'un seul foldamère hélicoïdal mimer. Crédit :Ivan Huc, LMU
Non seulement les molécules synthétiques peuvent imiter les structures de leurs modèles biologiques, ils peuvent également assumer leurs fonctions et peuvent même les concurrencer avec succès, comme le montre maintenant une séquence d'ADN artificielle conçue par Ludwig-Maximilians-Universitaet (LMU) à Munich, le chimiste Ivan Huc.
Le chimiste Ivan Huc trouve l'inspiration pour son travail dans les principes moléculaires qui sous-tendent les systèmes biologiques. En tant que leader d'un groupe de recherche consacré à la chimie supramoléculaire biomimétique, il crée des molécules « non naturelles » avec des définitions, des formes prédéterminées qui ressemblent étroitement aux principaux polymères biologiques, protéines et ADN trouvés dans les cellules. Les squelettes de ces molécules sont appelés « foldamères » parce que, comme les modèles d'origami, ils adoptent des formes prévisibles et peuvent être facilement modifiés. Après avoir rejoint LMU depuis son ancien poste à l'Université de Bordeaux l'été dernier, Huc a synthétisé une molécule hélicoïdale qui imite si étroitement les caractéristiques de surface de la double hélice d'ADN que de véritables protéines de liaison à l'ADN interagissent avec elle.
Ce travail est décrit dans un article publié dans Chimie de la nature . La nouvelle étude montre que le composé synthétique est capable d'inhiber les activités de plusieurs enzymes de traitement de l'ADN, dont l'« intégrase » utilisée par le virus de l'immunodéficience humaine (VIH) pour insérer son génome dans celui de sa cellule hôte. La démonstration réussie de l'efficacité de l'imitation d'ADN synthétique pourrait conduire à une nouvelle approche du traitement du SIDA et d'autres maladies rétrovirales.
Le nouveau document s'appuie sur les avancées décrites dans deux publications précédentes dans Chimie de la nature publié plus tôt cette année. Dans le premier de ces articles, Huc et ses collègues ont développé un modèle d'interactions de liaison nécessaires pour permettre aux molécules synthétiques de prendre des formes stables similaires aux squelettes hélicoïdaux des protéines. Dans la seconde, ils ont élaboré les conditions requises pour joindre leur hélice synthétique aux protéines naturelles lors de la synthèse par les ribosomes cellulaires. "Comme toujours en biologie, la forme détermine la fonction, " explique-t-il. Dans la nouvelle étude, il introduit une molécule synthétique qui se replie en une structure hélicoïdale qui imite les caractéristiques de surface de la double hélice d'ADN, et dont la forme précise peut être modifiée de façon modulaire par la fixation de divers substituants. Cela permet à l'expérimentateur d'imiter en détail la forme de la double hélice naturelle de l'ADN, en particulier la position des charges négatives. L'imitation est si convaincante qu'elle agit comme un leurre pour deux enzymes de liaison à l'ADN, dont l'intégrase du VIH, qui s'y fixent facilement et sont essentiellement inactivés.
Cependant, la question cruciale est de savoir si le foldamère peut rivaliser efficacement pour les enzymes en présence de leur substrat d'ADN normal. "Si les enzymes se lient toujours au foldamère dans des conditions compétitives, alors le mimique doit être un meilleur liant que l'ADN naturel lui-même, " dit Huc. Et en effet, l'étude démontre que l'intégrase du VIH se lie plus fortement au foldamère qu'à l'ADN naturel. "En outre, bien qu'initialement conçu pour ressembler à l'ADN, le foldamère doit ses propriétés les plus utiles et les plus précieuses aux caractéristiques qui le différencient de l'ADN, " fait remarquer Huc.
Grâce à la nature modulaire de la conception foldamer, les structures de ces imitateurs d'ADN artificiels peuvent être facilement modifiées, qui permet de produire une large gamme de variantes en utilisant la même plate-forme de base. Dans l'étude actuelle, Huc et ses collègues se sont concentrés sur les enzymes qui sont génériquement capables de se lier à l'ADN, indépendamment de sa séquence de base. Cependant, il peut également être possible d'utiliser l'approche foldamère pour développer des imitateurs d'ADN qui peuvent bloquer l'action de nombreuses protéines importantes de liaison à l'ADN dont les fonctions dépendent de la reconnaissance de séquences nucléotidiques spécifiques.