
Représentation artistique d'une membrane avec des protéines intégrées :des chercheurs de l'ETH Zurich ont développé une méthode qui donnera une impulsion à l'élucidation structurelle de telles molécules. Crédit :www.colourbox.com
Des chercheurs de l'ETH ont développé une nouvelle méthode de cristallisation de grandes protéines membranaires afin de déterminer leur structure. Cela profitera à la recherche biologique et à l'industrie pharmaceutique.
Les protéines membranaires sont une partie essentielle des cellules et de toute forme de vie. Ils existent non seulement dans de nombreuses variétés différentes, mais aussi remplir un large éventail de fonctions, allant de la communication intracellulaire et le transport de substances dans ou hors de la cellule à la médiation de la réponse immunitaire. Les protéines membranaires sont considérées comme des structures cibles thérapeutiques et diagnostiques importantes. Si leur structure et leurs fonctions sont connues, les chercheurs pharmaceutiques peuvent développer des substances actives qui influencent ces fonctions de manière ciblée.
Jusqu'à maintenant, cependant, élucider la structure des protéines membranaires a été très difficile car il faut d'abord que les chercheurs isolent un grand nombre de ces molécules et en forment des cristaux. C'est là que réside la difficulté :les protéines membranaires sont insolubles dans l'eau et souvent trop grosses et hétérogènes pour être cristallisées avec les méthodes classiques.
Maintenant, le groupe dirigé par Raffaele Mezzenga, Professeur d'aliments et de matériaux mous à l'ETH Zurich, s'efforce d'éliminer cette restriction. Dans une publication dans la revue Communication Nature , le groupe présente une méthode générale, qui peut être utilisé pour cristalliser des protéines membranaires de tout type ou taille.
Mélange lipide-eau comme chambre de réaction
Les bases de la nouvelle méthode ont été posées dans les années 1990 avec la méthode dite « en méso cristallisation » :les protéines sont isolées et concentrées à l'aide de mélanges eau-lipides stables appelés mésophases lipidiques. Dans les mésophases de ce genre, un processus d'auto-assemblage conduit à un réseau tridimensionnel de canaux d'eau coudés dont les parois sont constituées de lipides, comme dans une biomembrane. Ces canaux d'eau ont généralement un diamètre de 3 à 4 nanomètres, et le motif cubique de base du réseau se répète à intervalles réguliers.
Dans les canaux de ce genre, les protéines membranaires s'incorporent dans les parois en utilisant la partie hydrophobe qui se trouve autrement dans la membrane cellulaire. Le reste de la protéine se retrouve à l'intérieur du canal d'eau, et les protéines, une fois correctement reconstitué, peut alors commencer à se cristalliser. C'est précisément parce que les canaux offrent si peu d'espace que dans le passé, seules les petites protéines membranaires pouvaient être cristallisées – les grosses protéines étaient écrasées et ne formaient pas de cristaux.
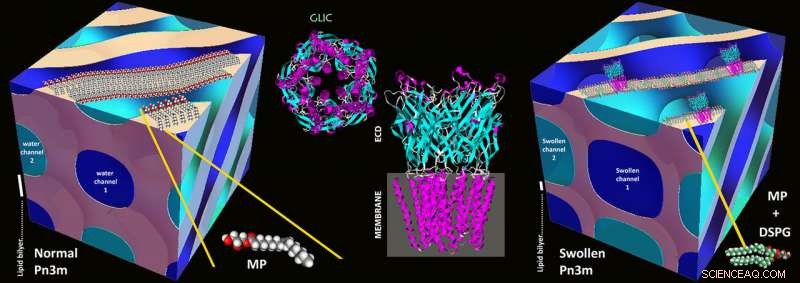
Illustrations schématiques d'une mésophase cubique Pn3m normale composée de MP:eau (à gauche), Structure de la protéine GLIC (milieu), et dans la cristallisation méso de la protéine GLIC dans une mésophase cubique Pn3m hautement gonflée composée de DSPG:MP:water (à droite). Crédit :Zabara A et al, Comm.nat., 2018
Canaux élargis à l'aide de lipides chargés
Les chercheurs de l'ETH ont maintenant utilisé une astuce pour élargir les canaux :ils ont mélangé une petite proportion de lipides chargés électriquement avec les lipides. Ceux-ci se repoussent et gonflent ainsi les canaux, augmentant leur diamètre à 20 nanomètres. Bien que les premières tentatives pour gonfler électrostatiquement les canaux d'eau dans les mésophases lipidiques remontent au début des années 2000 et se soient poursuivies régulièrement jusqu'à récemment, il s'agit de la première évolution démontrée de cette stratégie en une méthodologie d'importance générale.
Grâce à ces mésophases lipidiques gonflées, En effet, Mezzenga et ses collègues ont réussi à cristalliser de grandes protéines membranaires, puis à élucider leur structure.
Les chercheurs de l'ETH se sont exercés sur la protéine membranaire appelée GLIC (Gloeobacter ligand-gated ion channel), qui vient des bactéries. GLIC a plusieurs grandes sous-unités qui se trouvent à l'extérieur de la membrane bactérienne dans la partie externe de la cellule. Autrefois, une méthode différente a été utilisée pour cristalliser ce complexe car ces domaines étaient trop grands. "Notre procédure a non seulement amélioré la cristallisation, mais a également produit des cristaux extrêmement compacts appartenant à un nouveau groupe cristallographique pour cette protéine, " dit Mezzenga. De plus, les chercheurs ont pu pour la première fois cristalliser cette protéine canal dans sa configuration fermée. Jusqu'à maintenant, les chercheurs n'ont pu cristalliser le complexe qu'à l'état ouvert en utilisant une méthode différente.
Coup de pouce attendu pour l'élucidation structurelle
La nouvelle méthode "généralisée in méso" est susceptible d'être d'un grand intérêt pour les biologistes structurels en particulier, qui jusqu'à présent ont lutté pour élucider la structure des grandes protéines membranaires. "Cet outil va donner un nouvel élan à l'élucidation structurale, car il ouvre des protéines qui étaient auparavant hors de portée, " dit Mezzenga.
Maintenant, les scientifiques connaissent la structure exacte de seulement 360 petites protéines membranaires, ou environ un septième de toutes les protéines membranaires. La structure des nombreuses protéines membranaires restantes est inconnue.
Selon Mezzenga, la recherche peut également profiter à l'industrie pharmaceutique. "La capacité de déterminer la structure est d'une importance primordiale pour le développement de nouveaux médicaments, " dit-il. " Cette méthode facilitera considérablement la tâche et donnera un nouvel élan dans le domaine. "