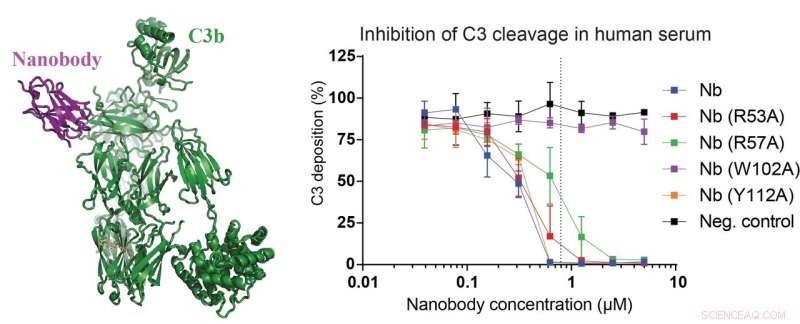
Le panneau de gauche de la figure affiche la structure du nanocorps nouvellement développé (magenta) lié à un fragment C3 appelé C3b (vert). Dans les panneaux de droite, des données démontrant que le nanocorps et ses mutants sont capables d'inhiber le clivage de C3 dans 15 pour cent de sérum humain. Les chercheurs ont également construit un mutant de nanocorps qui perd complètement son effet inhibiteur sur le clivage C3 (courbe violette), ce qui en fait un contrôle négatif parfait. Crédits :Rasmus Kjeldsen Jensen et Janus Asbjørn Schatz-Jakobsen, Université d'Aarhus
Des chercheurs du Département de biologie moléculaire et de génétique et du Département de biomédecine de l'Université d'Aarhus ont développé et décrit en collaboration un anticorps de lama qui pourrait avoir un impact significatif pour le diagnostic et le traitement futurs de, par exemple., maladies rénales.
L'équipe de recherche a étudié une protéine appelée C3 de la partie du système immunitaire inné connue sous le nom de système du complément. Lors de la reconnaissance d'organismes pathogènes ou de cellules corporelles mourantes, C3 est clivé par les enzymes du sang dans le cadre d'un mécanisme de défense. Ces enzymes sont connues sous le nom de convertases C3, et le clivage de C3 donne deux fragments. Le fragment appelé 3b se lie directement aux agents pathogènes, tandis que l'autre fragment recrute et stimule les cellules immunitaires pour éliminer la cible.
Chez une personne en bonne santé, les cellules sont protégées contre les effets du clivage C3. Cependant, suite à des mutations de l'ADN, cette protection pourrait être perdue, augmentant le risque de développer des troubles inflammatoires chroniques ou des maladies auto-immunes. Pendant longtemps, les chercheurs se sont concentrés sur le développement d'agents qui empêchent une telle activation indésirable du complément. Pour cette raison, ils ont développé l'anticorps de lama pour empêcher le clivage de C3. Les anticorps de lama sont également connus sous le nom de nanocorps en raison de leur petite taille, et par rapport aux anticorps normaux, ils sont faciles à développer et nettement moins chers à produire.
« La technologie utilisée pour développer et produire ces nanocorps est connue depuis plus de deux décennies, " dit Gregers Rom Andersen. " Et donc, il est quelque peu surprenant que nous soyons les premiers au monde à développer un nanocorps qui inhibe le système du complément."
En exposant les cristaux aux rayons X et en corrélant les résultats avec les données de la microscopie électronique, les chercheurs ont décrit en détail comment leur nanocorps se lie au C3.
"La structure cristalline de notre nanocorps lié à C3 soutient nos modèles proposés précédemment décrivant comment les convertases du complément reconnaissent leurs substrats et explique donc clairement pourquoi notre nanocorps exerce son effet inhibiteur sur le clivage de C3. Nos résultats améliorent également la compréhension de base de la façon dont ce nanocorps exerce son effet inhibiteur sur le clivage de C3. mécanisme essentiel au sein du système du complément fonctionne.En comparant avec les structures protéiques publiées précédemment, on peut en outre expliquer pourquoi notre nanocorps inhibe la formation des convertases C3, notre nanocorps a un effet 'double inhibiteur' pour ainsi dire, " explique Rasmus Kjeldsen Jensen.
En plus des travaux décrivant le complexe C3-nanocorps, l'équipe de recherche a également effectué plusieurs expériences de laboratoire en utilisant du sérum de souris et d'humains. Ces résultats confirment les observations de la structure atomique et révèlent clairement que leur nanocorps nouvellement développé inhibe le clivage de C3 dans le sérum humain et murin. Ce dernier est important, puisque les souris sont souvent utilisées comme modèles de maladie.
"Nos expériences dans le sérum sont importantes car elles montrent que notre nanocorps fonctionne réellement dans des conditions physiologiques, où le système du complément exerce naturellement sa fonction. Ces résultats indiquent que notre nanocorps pourrait être utilisé dans le traitement de maladies causées par une suractivation du système du complément. Par exemple, une partie du rein n'est pas protégée contre le complément au même degré que les autres tissus, et dans ce cas, notre nanocorps pourrait être un candidat pour arrêter la progression de la maladie induite par le complément, " dit Gregers Rom Andersen. " Cependant, nous avons également constaté que notre nanocorps est capable d'inhiber les effets protecteurs que notre propre corps exerce normalement contre le complément, et il faut donc être très prudent et évaluer méticuleusement les effets secondaires possibles du traitement thérapeutique des maladies à l'aide de notre nanocorps, " conclut Gregers Rom Andersen.
La base de ce travail a été établie par les deux professeurs adjoints Kasper Røjkjær Andersen et Nick Stub Laursen du Département de biologie moléculaire et de génétique, qui ont été les premiers au Danemark à développer et produire systématiquement des nanocorps à grande échelle. Cependant, la force motrice du projet était le doctorant Rasmus Kjeldsen Jensen sous la direction du professeur Gregers Rom Andersen, qui dans la caractérisation du nanocorps a été assisté par les deux doctorants Trine Amalie Fogh Gadeberg et Rasmus Pihl.