Crédit :Agence japonaise pour la science et la technologie (JST)
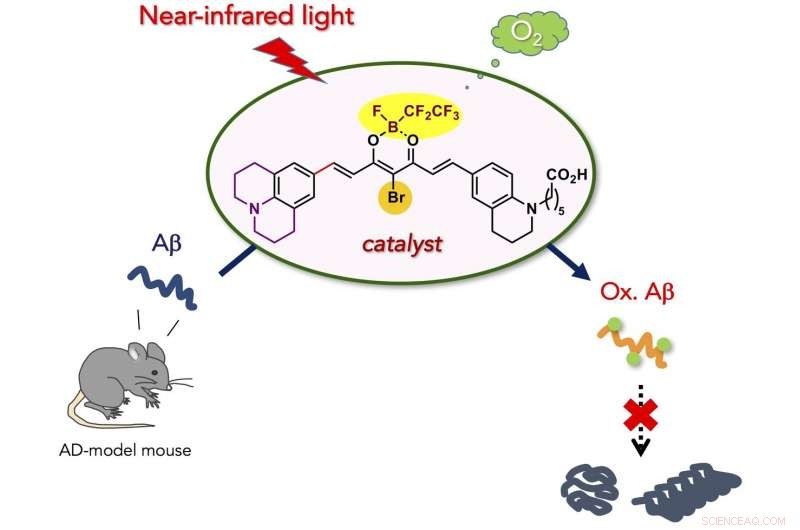
Un nouveau, un catalyseur de photooxygénation biocompatible qui peut sélectivement oxygéner et dégrader l'agrégation pathogène du peptide amyloïde-β (Aβ) lié à la maladie d'Alzheimer (MA) sous irradiation lumineuse proche infrarouge (NIR). Le catalyseur a été capable d'oxygéner Aβ incrusté sous la peau d'une souris vivante, et une diminution du niveau d'Aβ intact dans le cerveau de souris modèle AD. Le nouveau catalyseur est potentiellement applicable pour le traitement des maladies amyloïdes périphériques et de la MA.
L'agrégation toxique du peptide et de la protéine amyloïde est intimement liée à un certain nombre de maladies humaines. L'amyloïde-β (Aβ) est un peptide amyloïde représentatif dont l'agrégation est liée à la pathogenèse de la maladie d'Alzheimer (MA). Le développement d'un système chimique artificiel qui convertit sélectivement les agrégats amyloïdes toxiques en espèces non toxiques dans des conditions physiologiques, supprimant ainsi potentiellement le processus pathogène, pourrait être une nouvelle stratégie thérapeutique pour traiter les maladies amyloïdes actuellement incurables, y compris AD.
Les chercheurs ont envisagé que l'oxygénation aérobie photocatalysée serait une réaction chimique appropriée pour atténuer les propriétés d'agrégation pathogènes de l'Aβ dans des conditions physiologiques. Parce que l'agrégation des peptides et des protéines dépend généralement des interactions hydrophobes intermoléculaires, installation covalente d'atomes d'oxygène hydrophiles sur un peptide ou une protéine (c'est-à-dire, oxygénation) diminuerait la propriété d'agrégation. Nous avons précédemment signalé que l'oxygénation aérobie de Aβ se déroule en présence de photocatalyseurs à base de Flavine (vitamine B2), et l'Aβ oxygéné résultant présente une capacité d'agrégation et une toxicité très faibles. Après, des catalyseurs de photooxygénation plus sélectifs, activé uniquement lors de la détection d'une structure amyloïde d'ordre supérieur toxique, ont été développés sur la base d'une sonde de fluorescence pour le peptide et la protéine amyloïdes agrégés. L'application in vivo des catalyseurs a été, cependant, impraticable, parce que l'irradiation avec la lumière visible, qui a une faible pénétration dans les tissus, était nécessaire pour l'excitation du catalyseur. Pour une application in vivo, les photocatalyseurs doivent pouvoir fonctionner sous excitation avec une lumière de longueur d'onde plus longue, appelée "fenêtre optique" dans laquelle le tissu vivant absorbe relativement peu de lumière.
Ici, nous avons développé un catalyseur de photooxygénation biocompatible qui peut sélectivement oxygéner et dégrader l'agrégation pathogène d'Aβ sous irradiation lumineuse proche infrarouge (NIR). Le catalyseur présentait quatre avantages principaux par rapport aux catalyseurs précédents pour la dégradation de l'Aβ agrégé et toxique :(1) Une sélectivité élevée pour l'Aβ agrégé qui découle de l'interrupteur marche/arrêt de détection de la structure amyloïde d'ordre supérieur pour l'activité du catalyseur. La sélectivité cible précise a permis la photooxygénation de l'Aβ agrégé en présence des cellules et dans le lysat de cerveau de souris. (2) Faible toxicité pour les cellules. L'optimisation structurelle du catalyseur a nettement réduit la cytotoxicité, à la fois dans l'obscurité et sous irradiation NIR. (3) Fort pouvoir d'oxygénation sous photoirradiation NIR. En raison de la perméabilité tissulaire de la lumière NIR, la photooxygénation de l'Aβ agrégé sous la peau de la souris a été possible avec un rendement élevé. (4) Applicabilité au cerveau animal vivant in vivo. L'injection du catalyseur dans le cerveau de souris modèle AD avec une irradiation à la lumière NIR a conduit à une diminution significative du niveau d'Aβ intact dans le cerveau. Les résultats obtenus dans cette étude sont une étape importante vers l'utilisation de la catalyse artificielle comme stratégie thérapeutique potentielle contre les maladies amyloïdes.