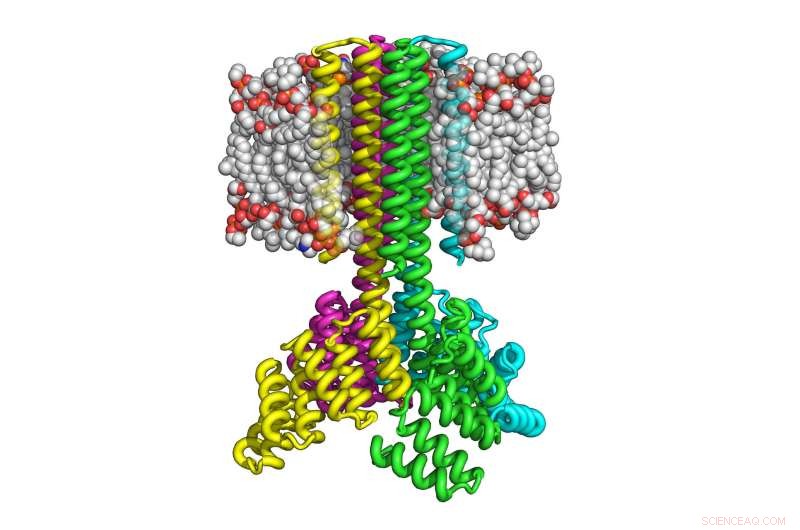
Cette illustration montre comment quatre copies d'une protéine transmembranaire conçue par ordinateur se sont assemblées pour former un tétramère en forme de fusée avec une large base cytoplasmique qui se transforme en huit hélices transmembranaires et qui s'oriente correctement dans la membrane. Crédit : Institut de conception de protéines de l'Université de Washington
Il est désormais possible de créer des complexes, des protéines transmembranaires conçues sur mesure à partir de zéro, les scientifiques rapportent cette semaine. L'avance, dirigé par des ingénieurs moléculaires de l'Institute for Protein Design de l'Université de Washington, permettra aux chercheurs de créer des protéines transmembranaires introuvables dans la nature pour effectuer des tâches spécifiques.
Dans le monde vivant, les protéines transmembranaires se trouvent incrustées dans la membrane de toutes les cellules et organites cellulaires. Ils sont indispensables à leur fonctionnement normal. Par exemple, de nombreuses protéines transmembranaires naturelles agissent comme des passerelles pour le mouvement de substances spécifiques à travers une membrane biologique. Certaines protéines transmembranaires reçoivent ou transmettent des signaux cellulaires. En raison de ces rôles, de nombreux médicaments sont conçus pour cibler les protéines transmembranaires et modifier leur fonction.
"Nos résultats ouvrent la voie à la conception de protéines membranaires multi-étendues qui pourraient imiter des protéines trouvées dans la nature ou avoir une structure entièrement nouvelle, fonction et utilisations, " a déclaré David Baker, un professeur de biochimie de la faculté de médecine de l'Université de Washington et directeur de l'UW Institute of Protein Design qui a dirigé le projet. La recherche est publiée dans le numéro du 1er mars de la revue Science . Peilong Lu, un senior fellow au laboratoire Baker, est l'auteur principal de l'article.
Mais comprendre comment les protéines transmembranaires sont assemblées et comment elles fonctionnent s'est avérée difficile. Parce qu'ils agissent alors qu'ils sont intégrés dans la membrane cellulaire, les protéines transmembranaires se sont avérées plus difficiles à étudier que les protéines qui opèrent dans la solution aqueuse qui constitue le cytoplasme des cellules ou dans le liquide extracellulaire.
Dans la nouvelle étude, Lu et ses collègues ont utilisé un programme informatique, développé dans le laboratoire Baker et appelé Rosetta, qui peut prédire la structure dans laquelle une protéine se repliera après avoir été synthétisée. L'architecture d'une protéine est cruciale car la structure d'une protéine détermine sa fonction.
La forme d'une protéine se forme à partir d'interactions complexes entre les acides aminés qui composent la chaîne protéique et entre les acides aminés et le milieu environnant. Finalement, la protéine prend la forme qui équilibre le mieux tous ces facteurs afin que la protéine atteigne l'état énergétique le plus bas possible.
Le programme Rosetta utilisé par Lu et ses collègues peut prédire la structure d'une protéine en prenant en compte ces interactions et en calculant l'état énergétique global le plus bas. Il n'est pas rare que le programme crée des dizaines de milliers de structures modèles pour une séquence d'acides aminés, puis identifie celles dont l'état d'énergie est le plus bas. Il a été démontré que les modèles résultants représentent avec précision la structure que la séquence adoptera probablement dans la nature.
Déterminer la structure des protéines transmembranaires est difficile car des portions de protéines transmembranaires doivent traverser l'intérieur de la membrane, qui est composé de graisses huileuses appelées lipides.
Dans les fluides aqueux, les résidus d'acides aminés qui ont des chaînes latérales polaires - des composants qui peuvent avoir une charge dans certaines conditions physiologiques ou qui participent à la liaison hydrogène - ont tendance à être situés à la surface de la protéine où ils peuvent interagir avec l'eau, qui a des charges latérales négatives et positives sur sa molécule. Par conséquent, les résidus polaires sur les protéines sont appelés hydrophiles, ou « aimant de l'eau ».
Résidus non polaires, d'autre part, ont tendance à se trouver emballés dans le noyau protéique loin du fluide aqueux polaire. De tels résidus sont appelés hydrophobes ou "craignant l'eau". Par conséquent, l'interaction entre les résidus hydriques et craignant l'eau de la protéine et les fluides aqueux environnants aide à entraîner le repliement des protéines et stabilise la structure finale de la protéine.
Dans les membranes, cependant, le repliement des protéines est plus compliqué car l'intérieur lipidique de la membrane est non polaire, C'est, il n'a pas de séparation des charges électriques. Cela signifie que pour être stable, la protéine doit être non polaire, résidus aquifères à sa surface, et emballe sa polaire, résidus d'eau à l'intérieur. Ensuite, il doit trouver un moyen de stabiliser sa structure en créant des liaisons entre les résidus hydrophiles au sein de son noyau.
La clé pour résoudre le problème, dit Lou, était d'appliquer une méthode développée par le laboratoire Baker pour concevoir des protéines de telle sorte que le polaire, les résidus hydrophiles s'adaptent de manière à former suffisamment d'interactions polaires-polaires qui peuvent lier la protéine de l'intérieur.
« Rassembler ces « réseaux de liaisons hydrogène enfouies » était comme monter un puzzle, " dit Boulanger.
Avec cette approche, Lu et ses collègues ont pu fabriquer les protéines transmembranaires conçues à l'intérieur de bactéries et de cellules de mammifères en utilisant jusqu'à 215 acides aminés. Les protéines résultantes se sont avérées très stables thermiquement et capables de s'orienter correctement sur la membrane. Comme les protéines transmembranaires naturelles, les protéines sont multipasses, ce qui signifie qu'ils traversent la membrane plusieurs fois, et assembler en complexes multiprotéiques stables, tels que les dimères, trimères et tétramères.
"Nous avons montré qu'il est désormais possible de concevoir avec précision des complexes, protéines transmembranaires multipasses qui peuvent être exprimées dans les cellules. Cela permettra aux chercheurs de concevoir des protéines transmembranaires avec des structures et des fonctions entièrement nouvelles, " dit Lou.