Crédit: Sciences chimiques (2020). DOI :10.1039/D0SC04993J
Les scientifiques ont découvert la première preuve du repliement des protéines induit par la séparation des phases liquide-liquide, un phénomène dans lequel les fluides se forment en gouttelettes microscopiques et se séparent à l'intérieur des cellules, comme des gouttes d'huile dans l'eau.
Dans une étude publiée dans la revue Sciences chimiques , des chercheurs de l'Université de Notre Dame ont découvert que des concentrations élevées de protéines dans les gouttelettes déclenchaient un événement de repliement, augmenter le potentiel d'agrégation de protéines - ou de mauvais repliement - qui a été lié à des maladies neurologiques, notamment la maladie d'Alzheimer et la sclérose latérale amyotrophique (SLA).
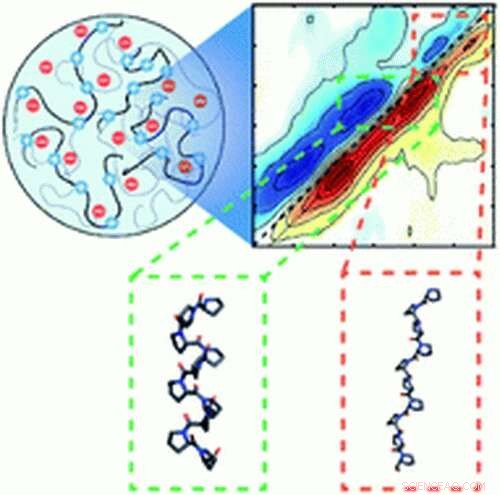
"Ces protéines particulières sont intrinsèquement désordonnées - elles n'ont pas de structure bien définie - mais lorsqu'elles sont forcées ensemble par ces gouttelettes, nous voyons des preuves de pliage, " dit Arnaldo Serrano, professeur adjoint au Département de chimie et de biochimie de Notre Dame et chercheur principal de l'étude. Les protéines sont naturellement informes, comme des morceaux de spaghetti cuits - et ne fonctionnent que lorsqu'ils sont pliés en structures tridimensionnelles. "Imaginez que vous êtes dans une foule, et tout le monde dans la foule a les bras tendus. Tu ne vas pas très bien t'emboîter. Tu rentres tes bras, et peut-être rassembler vos mains. Quand il y a du monde, ces protéines se condensent en une structure repliée."
Au cours des années, les chercheurs ont étudié comment les gouttelettes microscopiques, se formant naturellement et spontanément au sein des structures cellulaires, remplir plusieurs fonctions. Les cellules peuvent diriger et contenir des biomatériaux dangereux dans les compartiments de fluide pour protéger la cellule des dommages. Il existe également des preuves qu'ils peuvent entraîner diverses réactions chimiques telles que l'agrégation de protéines.
Dans leur étude, Serrano et son équipe ont utilisé la spectroscopie infrarouge pour mesurer le repliement d'une protéine spécifique associée à la SLA. Les lasers infrarouges créent des impulsions lumineuses, générer des fréquences vibratoires qui agissent comme un identifiant similaire à une empreinte digitale. La fréquence identifie de manière unique et précise la structure d'une protéine comme pliée ou dépliée.
Bien que la recherche n'ait pas testé la preuve de l'agrégation des protéines, Serrano a expliqué que le repliement et l'agrégation des protéines sont intimement liés.
"Vous pouvez considérer l'agrégation comme un événement de repliement de second ordre, " at-il dit. " Les protéines se replient souvent dans des structures intermédiaires le long du chemin vers l'agrégation. Nous avons validé cette idée que les protéines dans la gouttelette n'ont pas beaucoup de place et sont obligées de se replier - la prochaine étape logique est qu'elles sont obligées de s'agréger. »
Serrano a déclaré que lui et son équipe menaient actuellement une étude de suivi pour déterminer si un tel événement de repliement pourrait en fait servir de première étape pour un mauvais repliement dans d'autres protéines.