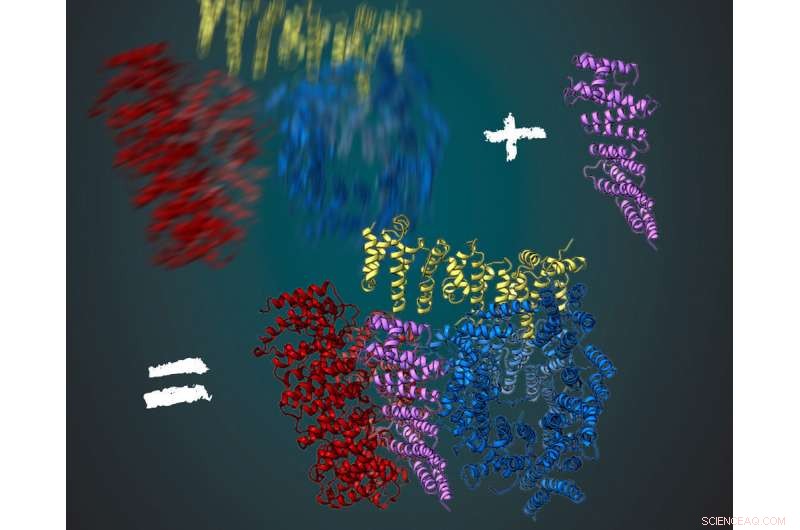
La protéine huntingtine est constituée de trois régions flexibles, indiqué en rouge, jaune et bleu. Avec son partenaire d'interaction HAP40 (violet), la huntingtine est plus stable. Cela a permis aux scientifiques de déduire leur structure tridimensionnelle en utilisant la cryomicroscopie électronique. Crédit :MPI de Biochimie/ Illustration :Gabriele Stautner, ARTIFOX
Mutations sur un seul gène, le gène de la huntingtine, sont à l'origine de la maladie de Huntington. Ils conduisent à une forme incorrecte de la protéine correspondante. Avec l'aide de chercheurs en microscopie cryoélectronique de l'Institut Max Planck de biochimie de Martinsried et de l'Université d'Ulm ont maintenant décodé la tridimensionnelle, structure moléculaire de la protéine huntingtine humaine saine. Cela permet maintenant son analyse fonctionnelle. Une meilleure compréhension de la structure et de la fonction de la protéine huntingtine pourrait contribuer au développement de nouvelles méthodes de traitement à l'avenir.
La maladie de Huntington commence souvent par des troubles émotionnels et se caractérise par des mouvements musculaires involontaires et une perte de capacité mentale. Jusqu'à aujourd'hui, la maladie neurologique fait partie des maladies héréditaires encore incurables et mortelles. La protéine HTT, aussi appelée huntingtine, joue le rôle central dans la maladie de Huntington. Depuis 25 ans, on sait que des mutations du gène de la huntingtine, qui est le modèle pour la même protéine, provoquer la maladie de Huntington.
Bien que les chercheurs y travaillent depuis de nombreuses années, il y a encore de nombreux obstacles à surmonter. Maintenant Rubén Fernández-Busnadiego de l'Institut Max Planck de biochimie et Stefan Kochanek, chef du service de thérapie génique à l'hôpital universitaire d'Ulm, ont réussi à décoder le moléculaire, structure tridimensionnelle de la protéine huntingtine.
Stefan Kochanek et son équipe travaillent depuis longtemps sur la production et la purification de la huntingtine. Qu'est-ce qui a empêché une analyse détaillée de la protéine au cours des dernières décennies ? Fernandez-Busnadiego, un expert en cryomicroscopie électronique, mentionne deux facteurs principaux :« Tout d'abord, La cryomicroscopie électronique n'a été optimisée que ces dernières années pour examiner les structures des protéines avec une résolution quasi moléculaire. La deuxième raison est que la protéine huntingtine est très flexible dans sa structure. Juste maintenant, nous avons également trouvé une solution à ce problème." Au cours de l'analyse, des images de la protéine sont prises sous différents angles au microscope. La structure moléculaire tridimensionnelle peut être calculée à partir du grand nombre d'images résultantes. Pour ça, la protéine doit toujours être dans la même conformation. Fernández-Busnadiego explique :« Ce serait similaire à une personne photographiée dans le noir. Si la personne ne reste pas immobile pendant un certain temps, la photo sera floue."
Pour obtenir une image claire, les chercheurs du laboratoire Kochanek ont recherché d'autres protéines qui interagissent avec la huntingtine et la stabilisent. Cela a fonctionné pour la protéine HAP40. "Huntingtin en relation avec HAP40 est stabilisé dans une conformation particulière. Ainsi, moyenné sur de nombreuses images, nous avons pu dériver la structure tridimensionnelle, " dit Kochanek. " Si nous restons dans l'analogie de la photo dans le noir, alors la protéine agit comme une chaise pour la personne photographiée. Assis dessus, la personne bouge beaucoup moins et l'image est beaucoup plus nette avec le même temps de pose, " ajoute Fernández-Busnadiego.
« Bien que l'on sache depuis un certain temps que la mutation du gène de la huntingtine a de graves conséquences, nous en savons encore relativement peu sur la fonction et les tâches de la protéine saine, " explique Kochanek. Les protéines sont les machines moléculaires de la cellule. Afin de remplir leurs tâches polyvalentes, ils ont une certaine structure tridimensionnelle, similaire à un composant spécifique d'une machine. "Maintenant que nous connaissons la structure exacte de la huntingtine, nous pouvons étudier plus avant quelles zones de la huntingtine sont particulièrement importantes et comment d'autres protéines coopèrent fonctionnellement avec la huntingtine. De cette façon, les structures pourraient être déduites d'être ciblées thérapeutiquement par certains médicaments. »
À l'heure actuelle, il se passe beaucoup de choses dans la recherche sur la maladie de Huntington. Un grand espoir est dirigé vers une méthode, qui mute le gène de la huntingtine avec des oligonucléotides dits antisens pour le traitement de la maladie de Huntington. Ces petites molécules réduisent la formation de protéines huntingtine dans les cellules, mais le médicament ne peut pas différencier entre la protéine huntingtine normale et la protéine huntingtine altérée pathologiquement. Aussi pour cette raison, il est important d'en savoir plus sur la fonction de la protéine huntingtine saine. Kochanek regarde avec confiance vers l'avenir :« La structure décodée nous apportera un grand pas en avant ».
« Les essais de traitement par oligonucléotides antisens ne sont actuellement menés que dans très peu de cliniques. La Clinique universitaire neurologique d'Ulm dirige les tests de dépistage des médicaments pour l'Allemagne. Certains des oligonucléotides antisens actuellement examinés réduisent à la fois la formation de la protéine huntingtine normale et mutante, tandis que d'autres cherchent principalement à abaisser la huntingtine altérée. Il est actuellement difficile de savoir si une inhibition partielle de la formation de protéine huntingtine normale présente des inconvénients et est tolérée sans effets secondaires indésirables. C'est encore une autre raison pour laquelle il est important d'en savoir plus sur la fonction normale de la protéine huntingtine. À cette fin, l'étude apportera une contribution importante, " dit Bernhard Landwehrmeyer, le directeur de la clinique ambulatoire Huntington du département de neurologie du centre médical universitaire d'Ulm.