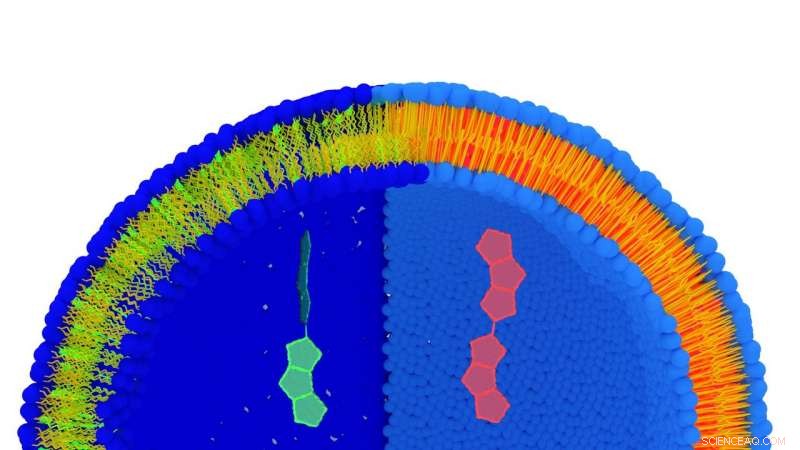
Vue d'artiste d'une membrane lipidique marquée de la molécule FliptR. Les lipides sont bleus (partie hydrophile) et jaunes (partie hydrophobe). Lorsque les lipides sont étirés (partie gauche) la molécule a une durée de vie courte (vert), alors que lorsque les lipides sont plus compacts, sa durée de vie est longue (rouge). Les deux conformations sont représentées à grande échelle au centre de l'image. Crédit :© UNIGE
Le volume des cellules peut varier considérablement. De la même manière qu'un ballon gonflant, l'augmentation de volume des cellules en croissance pousse sur la membrane plasmique, l'enveloppe lipidique qui entoure la cellule. Cette pression "turgescente" augmente la tension de la membrane, lequel, si elle n'est pas corrigée, finira par faire éclater la cellule. Pour éviter que cela ne se produise, les cellules ont développé des mécanismes pour surveiller la tension de leur membrane plasmique. Lorsque la tension est trop élevée, les cellules réagissent en augmentant la quantité de lipides dans la membrane. Inversement, lorsque la tension est trop faible, les cellules retirent les lipides de la membrane pour la « resserrer ». Comment les cellules parviennent à ressentir la tension et à déclencher la réponse biologique appropriée est restée un mystère. Il a été difficile à résoudre en raison du manque d'outils pour étudier la tension membranaire au sein des cellules vivantes. Pour résoudre ce problème, des chercheurs de l'Université de Genève (UNIGE) et du Centre national de recherche en biologie chimique (NCCR) ont collaboré pour créer une molécule fluorescente permettant de mesurer la tension de la membrane plasmique de cellules vivantes. Grâce à ce nouvel outil, ils ont alors pu découvrir comment les cellules adaptaient leur surface à leur volume. Ces résultats, Publié dans Chimie de la nature et Biologie cellulaire naturelle , ouvrir la voie à de nombreuses applications, y compris dans la détection de cellules cancéreuses qui présentent généralement une tension membranaire anormalement élevée.
Lorsque le volume d'une cellule augmente, la tension exercée sur sa membrane augmente, provoquant l'activation de TORC2, un complexe de protéines qui crée des signaux d'avertissement dans la cellule. « La membrane cellulaire est constituée de lipides organisés en une bicouche semi-perméable, " explique Aurélien Roux, professeur au Département de Biochimie de la Faculté des Sciences de l'UNIGE et membre du PRN. "Cette surface est fluide, permettant une grande adaptabilité de la membrane aux changements de forme et de volume de la cellule. Comme toute surface, il peut être étiré et l'espace entre les lipides augmente alors. Lorsque cet espace devient trop grand et que la membrane risque de se rompre, une protéine, nommé Slm1, active TORC2 pour produire des signaux qui poussent la cellule à produire de nouveaux lipides et à son tour à réduire la tension de la membrane cellulaire. » Mais comment les chercheurs ont-ils pu mesurer la tension nécessaire pour déclencher ce processus ?
Pour évaluer la tension de la membrane cellulaire, il faut pouvoir mesurer l'espace entre les lipides qui constituent cette membrane. Stefan Matile, professeur au Département de chimie organique de la Faculté des sciences de l'UNIGE et membre du PRN, a créé une "molécule sonde" appelée FliptR (Fluorescent Lipid Tension Reporter), qui s'intègre spontanément entre les lipides de la membrane plasmique. "Nous avons développé une molécule fluorescente avec deux petites "ailettes" qui définissent un certain angle entre elles, il explique. Cet angle varie en fonction de la pression exercée sur FliptR, qui modifie sa fluorescence." Profitant de cette différence dans les propriétés de fluorescence de la molécule, le groupe du professeur Roux a pu mesurer l'espace entre les lipides et donc la tension d'une membrane.
FliptR est un nouvel outil précieux pour mesurer la tension de la membrane plasmique dans les cellules vivantes. « Nous savons que les cellules cancéreuses ont une tension membranaire plus élevée que les cellules normales. Nous espérons que cette molécule fluorescente permettra un jour de les détecter plus facilement, " dit Stefan Matile.
Et quand il s'agit de réduire la tension de la cellule ?
Lorsque la tension de la membrane plasmique augmente, TORC2 est activé et cela déclenche la production de lipides pour ramener la tension aux valeurs basales. Mais que se passe-t-il lorsque la tension de la membrane est trop faible et doit être augmentée ? "Nous avons d'abord pensé que cela se passait par le même mécanisme fonctionnant à l'envers, mais l'histoire s'est avérée beaucoup plus intéressante, " dit Robbie Loewith, professeur au Département de biologie moléculaire de la Faculté des sciences de l'UNIGE et également membre du PRN. En effet, les premières recherches ont montré que l'activateur TORC2 Slm1 - impliqué dans la détection d'une tension membranaire élevée - ne joue étonnamment aucun rôle dans la réponse à une tension trop faible. "D'autre part, nous avons observé qu'un lipide particulier présent dans la membrane plasmique, appelé PIP2, est le capteur de faible tension membranaire."
Lorsque la tension membranaire diminue, PIP2, préalablement mélangé avec d'autres lipides, s'auto-sépare pour former des "îlots" PIP2 dans une mer de lipides restants dans la membrane, dans un processus semblable à la séparation spontanée (montée) de la crème dans le lait frais. Comme l'une des protéines de TORC2 se lie à PIP2, TORC2 redistribue également à ces îlots PIP2. Une fois englouti par ces îlots, TORC2 devient inactivé. « Les lipides de la membrane cellulaire sont naturellement dégradés, et l'activité TORC2 est nécessaire pour les remplacer ", explique Robbie Loewith. Mais lorsque TORC2 est inhibé dans les îlots PIP2, les lipides dégradés ne sont plus remplacés, entraînant une augmentation de la tension de la membrane plasmique. Si ce processus de recalibrage est bloqué, les cellules ne peuvent pas ajuster la tension de leur membrane plasmique et meurent.
Un outil de mesure chimique au service de la recherche en biologie
Grâce à la technique de mesure de tension développée par Stefan Matile et Aurélien Roux, les équipes des professeurs Roux et Loewith ont pu mener leurs expériences sur des levures et mesurer les variations de tension de la membrane plasmique. La tension membranaire est un paramètre très important à contrôler dans tous les processus cellulaires dans lesquels les membranes sont impliquées, comme la motilité, endocytose (le processus par lequel la cellule se nourrit), ou division cellulaire, et surtout dans le cas du développement du cancer. Les scientifiques s'attachent désormais à vérifier si le mécanisme observé chez la levure est le même dans les cellules humaines, avec l'idée à long terme de développer des médicaments capables de réguler TORC2, voire de prévenir le développement de certains cancers.