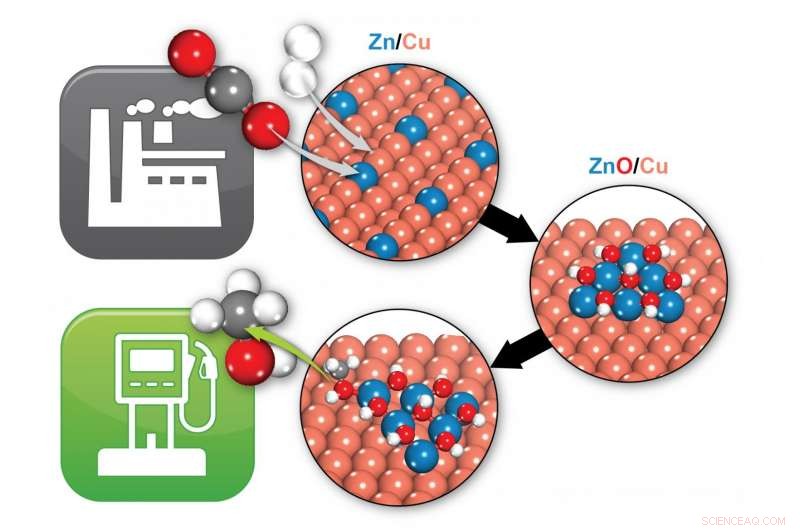
Les scientifiques de Brookhaven ont identifié comment un catalyseur zinc/cuivre (Zn/Cu) transforme le dioxyde de carbone (deux boules rouges et une grise) et l'hydrogène (deux boules blanches) en méthanol (une boule grise, un rouge, et quatre boules blanches), un carburant potentiel. Dans des conditions de réaction, Zn/Cu se transforme en ZnO/Cu, où l'interface entre le ZnO et le Cu fournit les sites actifs qui permettent la formation de méthanol. Crédit :Laboratoire national de Brookhaven
La capture du dioxyde de carbone (CO2) et sa conversion en produits chimiques utiles tels que le méthanol pourraient réduire à la fois la pollution et notre dépendance aux produits pétroliers. Les scientifiques s'intéressent donc intensément aux catalyseurs qui facilitent de telles conversions chimiques. Comme les négociateurs moléculaires, les catalyseurs rassemblent les produits chimiques réactifs d'une manière qui leur permet de rompre et de réorganiser plus facilement leurs liaisons chimiques. La compréhension des détails de ces interactions moléculaires pourrait indiquer des stratégies pour améliorer les catalyseurs pour des réactions plus économes en énergie.
Avec cet objectif en tête, des chimistes du Brookhaven National Laboratory du département américain de l'Énergie et leurs collaborateurs viennent de publier les résultats d'expériences et d'études de modélisation informatique qui identifient définitivement le "site actif" d'un catalyseur couramment utilisé pour fabriquer du méthanol à partir de CO2. Les résultats, publié dans la revue Science , résoudre un débat de longue date sur les composants catalytiques exacts qui participent aux réactions chimiques et devrait être au centre des efforts visant à améliorer les performances.
"Ce catalyseur fait de cuivre, oxyde de zinc, et l'oxyde d'aluminium-est utilisé dans l'industrie, mais ce n'est pas très efficace ou sélectif, " a déclaré le chimiste de Brookhaven Ping Liu, l'auteur principal de l'étude, qui occupe également un poste d'assistant à l'Université Stony Brook (SBU) à proximité. "Nous voulons l'améliorer, et le faire fonctionner à des températures et des pressions plus basses, ce qui permettrait d'économiser de l'énergie, " elle a dit.
Mais avant cette étude, différents groupes de scientifiques avaient proposé deux sites actifs différents pour le catalyseur - une partie du système avec juste des atomes de cuivre et de zinc, ou une partie avec de l'oxyde de cuivre et de zinc.
"Nous voulions savoir quelle partie de la structure moléculaire se lie, se brise et crée des liaisons pour convertir les réactifs en produit - et comment elle le fait, " a déclaré le co-auteur Jose Rodriguez, un autre chimiste de Brookhaven associé à SBU.
Découvrir, Rodriguez a effectué une série d'expériences en laboratoire en utilisant des catalyseurs modèles bien définis, dont une constituée de nanoparticules de zinc supportées sur une surface de cuivre, et un autre avec des nanoparticules d'oxyde de zinc sur du cuivre. Pour distinguer les deux, il a utilisé un faisceau de rayons X énergétique pour zapper les échantillons, et mesuré les propriétés des électrons émis. Ces "signatures" électroniques contiennent des informations sur l'état d'oxydation des atomes d'où proviennent les électrons, qu'il s'agisse de zinc ou d'oxyde de zinc.
Pendant ce temps Liu, Jingguang Chen du Brookhaven Lab et de l'Université de Columbia, et Shyam Kattel, le premier auteur de l'article et un boursier postdoctoral co-dirigé par Liu et Chen, utilisé les ressources informatiques du Brookhaven's Center for Functional Nanomaterials (CFN) et du National Energy Research Scientific Computing Center (NERSC) - deux installations pour les utilisateurs du DOE Office of Science - pour modéliser comment ces deux types de catalyseurs s'engageraient dans les transformations du CO2 en méthanol . Ces études théoriques utilisent des calculs qui prennent en compte les principes de base de la rupture et de la réalisation des liaisons chimiques, y compris l'énergie nécessaire, les états électroniques des atomes, et les conditions de réaction, permettant aux scientifiques de dériver les taux de réaction et de déterminer quel catalyseur donnera le meilleur taux de conversion.
"Nous avons constaté que l'oxyde de cuivre et de zinc devrait donner les meilleurs résultats, et que le cuivre-zinc n'est même pas stable dans les conditions de réaction, " dit Liu. " En fait, il réagit avec l'oxygène et se transforme en oxyde de cuivre et de zinc."

Ping Liu et Shyam Kattel avec la source de rayons X utilisée dans cette étude. Crédit :Laboratoire national de Brookhaven
Ces prédictions correspondaient à ce que Rodriguez avait observé en laboratoire. "Nous avons découvert que tous les sites participant à ces réactions étaient de l'oxyde de cuivre et de zinc, " il a dit.
Mais n'oubliez pas le cuivre.
« Dans nos simulations, tous les intermédiaires de réaction - les produits chimiques qui se forment sur la voie du CO2 au méthanol - se lient à la fois à l'oxyde de cuivre et de zinc, " dit Kattel. " Il y a donc une synergie entre le cuivre et l'oxyde de zinc qui accélère la transformation chimique. Vous avez besoin à la fois du cuivre et de l'oxyde de zinc."
L'optimisation de l'interface cuivre/oxyde de zinc deviendra le moteur de la conception d'un nouveau catalyseur, disent les scientifiques.
"Ce travail démontre clairement la synergie de la combinaison des efforts théoriques et expérimentaux pour l'étude des systèmes catalytiques d'importance industrielle, ", a déclaré Chen. "Nous continuerons à utiliser les mêmes approches combinées dans les études futures."
Par exemple, dit Rodriguez, "Nous allons essayer différentes configurations des atomes à l'interface cuivre/oxyde de zinc pour voir comment cela affecte la vitesse de réaction. De plus, nous passerons de l'étude du système modèle à des systèmes qui seraient plus pratiques à utiliser par l'industrie. »

Jingguang Chen et Jose Rodriguez (debout) discutent du mécanisme catalytique avec Ping Liu et Shyam Kattel (assis). Crédit :Laboratoire national de Brookhaven
Un outil essentiel pour cette prochaine étape sera Brookhaven's National Synchrotron Light Source II (NSLS-II), une autre installation utilisateur du Bureau des sciences. NSLS-II produit des faisceaux de rayons X extrêmement brillants - environ 10, 000 fois plus lumineuse que la source de rayons X de laboratoire à faisceau large utilisée dans cette étude. Ces faisceaux de rayons X intenses permettront aux scientifiques de prendre des instantanés à haute résolution qui révèlent à la fois des informations structurelles et chimiques sur le catalyseur, les réactifs, et les intermédiaires chimiques qui se forment au fur et à mesure que la réaction se produit.
"Et nous continuerons à étendre la théorie, " dit Liu. " La théorie pointe vers les détails mécanistes. Nous voulons modifier les interactions à l'interface cuivre/oxyde de zinc pour voir comment cela affecte l'activité et l'efficacité du catalyseur, et nous aurons également besoin de la théorie pour aller de l'avant."