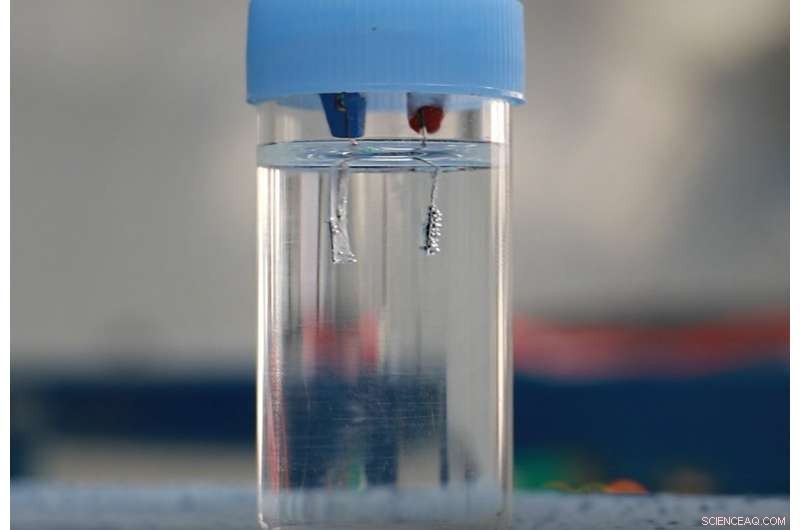
Évolution de l'oxygène à la surface d'une électrode core-shell Co@NC en électrolyse alcaline de l'eau. Crédit :Daegu Gyeongbuk Institute of Science and Technology (DGIST)
Une équipe de recherche dirigée par le professeur Sangaraju Shanmugam des sciences et de l'ingénierie de l'énergie à la DGIST a développé des électrocatalyseur nanostructuré core-shell ultra-durable et a remplacé avec succès l'anode précieuse dans l'électrolyse de l'eau, grâce à la collaboration avec le groupe de recherche du Pacific Northwest National Laboratory (PNNL).
Le remplacement des carburants conventionnels par des ressources énergétiques renouvelables est une approche appropriée pour parvenir à un environnement respectueux de l'environnement et réduire les futures demandes énergétiques. Ainsi, génération ou conversion d'énergie électrochimique dans des dispositifs d'énergie renouvelable, qui dépend des réactions anodiques et cathodiques, a reçu beaucoup d'attention.
Dans le fractionnement électrocatalytique de l'eau, de l'oxygène gazeux est généré dans l'anode en raison de la réaction de dégagement d'oxygène (OER), une réaction électrochimique lente par rapport à la réaction de dégagement d'hydrogène (HER). Ainsi, un électrocatalyseur approprié est nécessaire pour une séparation électrocatalytique stable de l'eau.
Développement d'efficacité, durable, les électrocatalyseurs OER à faible coût sont importants pour les dispositifs énergétiques à électrolyseur d'eau. Jusqu'à maintenant, les oxydes de ruthénium et d'iridium étaient considérés comme des électrocatalyseurs de pointe dans les REL, mais le manque de stabilité limite leur utilisation dans le fractionnement de l'eau à grande échelle, entraver la commercialisation à grande échelle.
L'équipe du professeur Shanmugam, avec des chercheurs du PNNL, se sont concentrés sur le développement d'une alternative low-cost, électrocatalyseur en métal non noble pour remplacer l'électrode d'anode en métal noble dans une séparation efficace de l'eau. Le métal supporté par du carbone est considéré comme un matériau électrocatalytique efficace pour une OER améliorée dans la division de l'eau. Jusque là, la plupart des électrocatalyseurs développés ont présenté une teneur en carbone plus élevée et une teneur spécieuse en métal actif moins. La quantité de carbone plus élevée a embourbé les vrais sites actifs métalliques, et a entraîné des conditions de corrosion du carbone plus rapides. Cela a conduit à une activité électrocatalytique plus faible.
Dans l'étude, les chercheurs ont découvert qu'un grand nombre d'ions métalliques cobalt inorganiques pontés par des ligands organiques dans le bleu de Prusse sont un précurseur approprié pour le développement ultra-stable, riche en métaux, électrocatalyseurs à noyau-coque encapsulés dans du nanocarbone graphitique dopé à l'azote pour l'OER lent (anode) dans le fractionnement de l'eau.
Lorsqu'il est chauffé (600 à 900 degrés C) dans une atmosphère inerte, les ions cobalt métalliques et les ligands organiques du sel sont transformés en couches minces de cobalt métallique et de carbone graphitique dopé à l'azote, respectivement, qui forment la fine couche de carbone, métallique encapsulé, nanostructures cœur-coquille en cobalt (Core-Shell Co@NC). Les fines couches de carbone ont une forte interaction avec le cobalt métallique, qui favorisent moins de corrosion du carbone, présenter un excellent mouvement des électrons, et avoir plus d'exposition au métal cobalt au milieu réactionnel, y compris la formation d'une morphologie nanométrique sans agrégation de particules.
L'effet combiné du carbone et du cobalt dans les électrodes permet d'obtenir une activité OER électrocatalytique plus efficace que les électrodes en métal précieux pour une séparation efficace de l'eau. Par conséquent, l'électrode riche en métaux non nobles est une alternative, actif, stable, et une anode OER moins chère pour une production de gaz H2 rentable dans l'électrolyse de l'eau à l'échelle commerciale.
« Nous prévoyons qu'il s'agira d'une approche unique pour développer des métaux riches, nanostructures composites à teneur réduite en carbone qui ont des sites métalliques actifs améliorés, qui présentent une protection en couche de carbone mince et un mouvement d'électrons ultra-rapide dans la surface du catalyseur, qui améliorera l'activité électrochimique et la stabilité des électrocatalyseurs, " dit le professeur Shanmugam. " Nous réaliserons les études de suivi qui pourront être utilisées pour comprendre le mécanisme réel des REL sur les espèces actives en présence d'un revêtement de nanocarbone. "
Ce résultat de recherche a été publié dans l'édition en ligne de Matériaux énergétiques avancés le 11 janvier 2018, une revue internationale réputée dans le domaine des matériaux émergents.
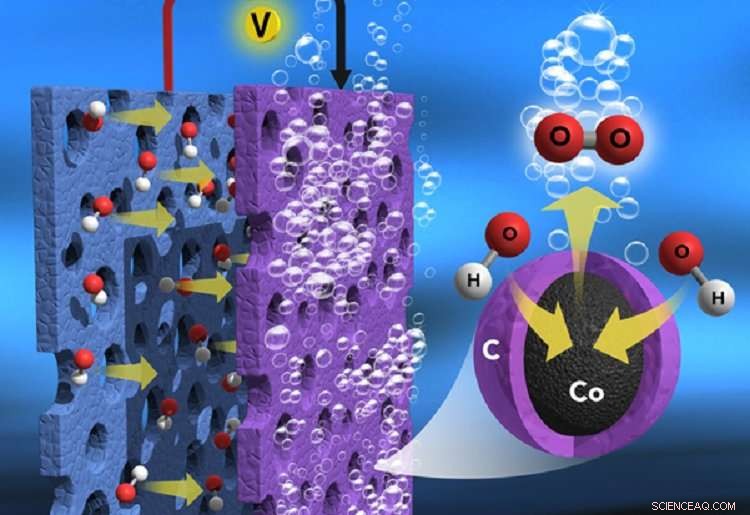
Représentation schématique de la division de l'eau et des mouvements d'électrons possibles à travers les couches de nanocarbone dans un seul atome de cobalt piégé par NC. Crédit :Daegu Gyeongbuk Institute of Science and Technology (DGIST)
Entretien avec le professeur Sangaraju Shanmugam (Département des sciences et de l'ingénierie énergétiques) :
Q. Quelles sont les différences par rapport aux études précédentes ?
A. Dans les études précédentes, les chercheurs ont préparé les métaux revêtus de carbone à partir de divers précurseurs, y compris les charpentes organométalliques (MOF). Les catalyseurs obtenus présentent plus de carbone à caractère graphitique réduit, et le carbone recouvrait les sites métalliques actifs. Ainsi, la plupart des sites métalliques actifs ne sont pas utilisés correctement par les réactions électrochimiques. Aussi, en raison de la corrosion importante du carbone, ces catalyseurs ne sont pas suffisamment adaptés à l'OER lent dans la division de l'eau au potentiel positif le plus élevé avec un manque d'instabilité dans des conditions électrolytiques difficiles. Par conséquent, dans ce travail, nous avons préparé le métal riche, des couches minces de nanocarbone (NC) ont encapsulé un électrocatalyseur de nanostructures core-shell Co@NC à partir d'un analogue précurseur unique du bleu de Prusse (PB). Le Co@NC a montré une activité de dégagement d'oxygène et une ultrastabilité accrues sur le collecteur de courant de mousse de nickel. Globalement, les couches de carbone minces et uniformes assurent les mouvements rapides des électrons, plus d'utilisation des sites actifs métalliques avec une pénétration facile de l'électrolyte. Plus important encore, it can protect the active metal sites from the corrosion with minimal exposing and also the strong interaction between metal and carbon layers exhibits the synergistic effect towards the excellent activity and ultra-stability (over 350 h) of core-shell Co@NC nanostructures with less possibility of carbon oxidation.
Q. How can it be utilized?
A. Based on the remarkable OER performance, kinetics and long-term stability of core-shell Co@NC nanostructures as compared to the state-of-the-art Noble metal based electrocatalysts, such as IrO2 and RuO2, it is the most suitable candidate to replace precious metal OER electrodes for reducing the overall cost of the water electrolyzer system. Ainsi, the development of efficient and durable non-noble metal electrocatalyst in water electrolyzer is the main obstacle for successful commercialization of water electrolyzers.
Q. How long will it be required for commercialization?
A. The process is readily available for the fabrication of cost-effective catalysts. But we still have to evaluate the integration of this catalytic system in a polymer electrolyte membrane electrolyzer .Studies are underway to understand the OER mechanism on this electrocatalyst. So for commercialization, it may require a year with complete understanding of activity and stability.
Q. What are the challenges for commercialization?
A. We have to make the uniform coating of this catalyst on the larger size current collectors without any peeling. So we need to find a more suitable coating methodology. Aussi, as with precious OER electrocatalysts, we have to understand the precise OER mechanism on this electrocatalysts to maintain/avoid activity losses due to the unwanted side reactions, etc.
Q. What is the motivation for your research?
A. The primary motivation of this work is to replace the precious anode in water electrolyzer systems with high activity and stability. So to improve the activity and stability, we tried to introduce the very thin carbon coating on the metal active sites. Globalement, the development metal-rich and carbon less OER electrocatalysts with proper utilization of metal-active species and metal-carbon synergistic effect to overcome the sluggish anode reaction in water electrolysis.
Q. What is the final goal you would like to achieve through this research?
A. Based on this research, we understand that the metal-rich electrocatalysts are among the most suitable materials for excellent OER activity. So we want to prepare the cheapest anode electrocatalysts by using the same methodology and eliminate the use of precious electrodes in the water electrolyzer system for the production of green and sustainable hydrogen in large scale.