La cryo-EM révèle un complexe modificateur de protéine critique et une cible potentielle de médicament
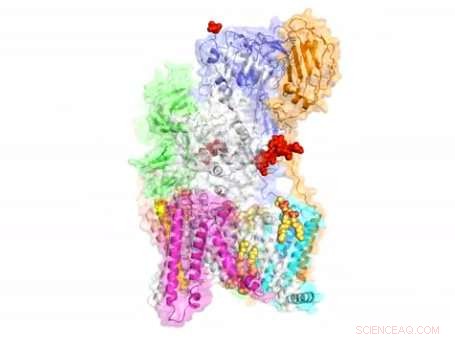
Les scientifiques ont révélé la structure au niveau atomique d'un complexe moléculaire responsable de la modification des protéines, ouvrant peut-être la voie au développement de nouveaux médicaments contre le cancer et une foule d'autres maladies.
Le complexe, connu sous le nom d'OST, est un acteur clé de la glycosylation des protéines, un processus cellulaire très répandu qui est intimement lié à de nombreuses fonctions du corps humain. Il agit en ajoutant des sucres appelés glycanes aux protéines, influençant leur forme et, par conséquent, leur fonction.
"La détermination de la structure au niveau atomique de l'OST est une percée en glycobiologie, " dit Huilin Li, Doctorat., professeur à l'Institut de recherche Van Andel (VARI) et auteur principal d'une étude décrivant la structure de l'OST publiée aujourd'hui dans La nature . "En tant qu'enzyme clé dans la voie de biosynthèse des glycanes liés à l'azote, Le TSO est important à la fois pour la santé et la maladie. Nous espérons que ces découvertes mèneront à des thérapies qui changeront la vie du cancer et de nombreux autres troubles. »
La plupart des protéines modifiées par l'OST sont soit sécrétées, soit incrustées dans la membrane de la surface cellulaire, où ils agissent comme un conduit entre la cellule et son environnement. Leur exposition à l'environnement des cellules et la présence de glycanes en font des cibles idéales pour de nouveaux médicaments, qui utilisent souvent les signatures chimiques spécifiques des glycanes pour se concentrer sur une cellule cancéreuse, par exemple.
Bien que l'OST ait été découverte il y a plusieurs décennies, sa structure est restée floue. La structure atomique de l'OST décrite dans l'article d'aujourd'hui provient de la levure de boulanger, un modèle simple et élégant pour la recherche biomédicale.
