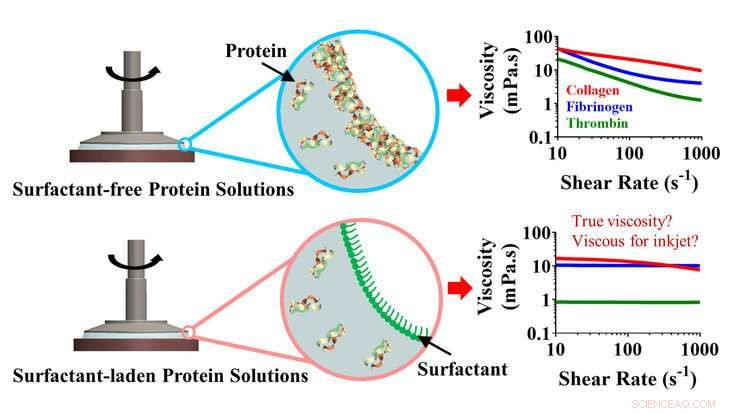
Le collagène et le fibrinogène en solutions aqueuses forment une couche solide à la surface de l'eau, corrompre les mesures du comportement de l'écoulement avec des rhéomètres rotatifs. L'ajout d'un tensioactif non ionique en petits volumes évite la formation de la couche solide, permettant une estimation précise du comportement d'écoulement des solutions. Crédit :Hemanth Gudapati, État de Pennsylvanie
Les protéines fibreuses telles que le collagène et le fibrinogène forment une fine couche solide à la surface d'une solution aqueuse semblable à la "peau" qui se forme sur le lait chaud, selon une équipe de Penn State Researchers, qui pensent que cette découverte pourrait conduire à une bio-impression et à une ingénierie tissulaire plus efficaces.
Dans le corps humain, les protéines fibreuses fournissent un support structurel aux cellules et aux tissus et aident à la biomécanique. Le collagène constitue 80% de notre peau et 10% de nos muscles, tandis que le fibrinogène aide à la coagulation du sang en formant la fibrine hydrogel.
"Les solutions de protéines de collagène et de fibrinogène sont largement utilisées comme précurseurs d'hydrogels de collagène et de fibrine dans les applications d'ingénierie tissulaire, " a déclaré Hemanth Gudapati, étudiant diplômé en sciences de l'ingénieur et mécanique. "C'est parce que le collagène et la fibrine, qui sont utilisés comme matériaux structurels pour l'ingénierie tissulaire similaire à leur rôle dans le corps humain, sont non toxiques, biodégradable et imite les microenvironnements naturels des cellules."
Gudapati et ses collègues chercheurs rapportent, dans Matière molle , pour la première fois que les protéines fibreuses forment une couche solide à la surface de l'eau en raison de l'agrégation de protéines à l'interface air/eau. Cette couche solide interfère avec les mesures précises de la rhéologie de la solution, qui est l'étude des propriétés des fluides telles que l'écoulement. Précédemment, il a seulement été démontré que l'autre type principal de protéine, protéines globulaires, formé ces couches solides à l'interface air/eau.
Des mesures de rhéologie précises sont vitales pour une bio-impression réussie. La mesure de la viscosité est importante pour identifier quelles solutions de protéines sont potentiellement imprimables, et pour détecter des incohérences dans le comportement d'écoulement entre différents lots de protéines fibreuses.
"Le collagène et le fibrinogène sont extraits d'animaux, et leur comportement d'écoulement change de lot en lot et avec le temps, " a déclaré Gudapati.
Cela conduit à son tour à un défi pour des résultats de bio-impression cohérents.
"La mesure précise du comportement du flux aide à une livraison fiable ou cohérente des solutions de protéines pendant la bio-impression, " a déclaré Gudapati. "Cela aide à la fabrication de choses telles que des dispositifs d'organes sur puce fiables et des modèles de maladies."
Une solution potentielle pour une mesure précise consiste à ajouter un tensioactif tel que le polysorbate 80 pour empêcher la formation de film à l'interface air/eau.
La recherche identifie également les concentrations de solutions protéiques potentiellement imprimables par bio-impression à jet d'encre, ainsi que l'identification des paramètres de fonctionnement de la bio-impression.
Gudapati a déclaré qu'il y avait d'autres découvertes dans leurs recherches qui nécessiteront une enquête plus approfondie. Ceux-ci comprenaient la possibilité que les protéines fibreuses agrégées à l'interface air/eau puissent être libérées de l'interface et que ces agrégats de protéines puissent provoquer une accumulation supplémentaire des protéines dans les solutions.
"L'agrégation en vrac supplémentaire pourrait être l'une des raisons du mauvais alignement des fibres de collagène ou de la mauvaise résistance mécanique de la fibrine à l'extérieur du corps, c'est à dire., in vitro, quels sont les défis auxquels sont confrontées les applications d'ingénierie tissulaire à l'heure actuelle, " a déclaré Gudapati.
Le travail a été effectué dans le laboratoire d'Ibrahim Ozbolat, Hartz Family Career Development Professeur agrégé de sciences de l'ingénieur et de mécanique, en collaboration avec Ralph Colby, professeur de science et génie des matériaux et de génie chimique.
"Le travail du Dr Colby avec des solutions de protéines globulaires a influencé notre travail, " dit Gudapati. " Par exemple, nous avons réalisé que les protéines fibreuses pouvaient se comporter de la même manière que les protéines globulaires à l'interface air/eau au début de nos recherches."