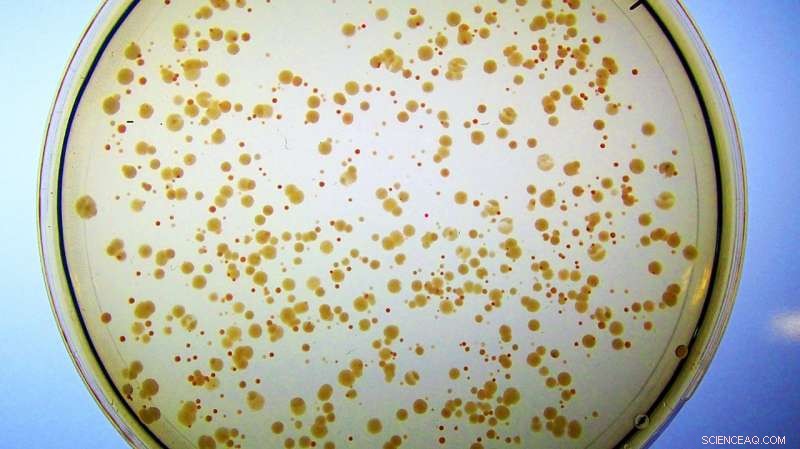
Les colonies d'E. coli se développent sur un milieu riche en fer. Toutes les cellules ont été conçues pour perdre leur enzyme Fes naturelle. Ils forment de petits, colonies rouges malsaines car elles accumulent du fer lié à l'entérobactine, et ont à peine assez de fer libre pour grandir. En revanche, les cellules contenant l'enzyme artificielle Syn-F4 forment de grandes, colonies blanches saines parce que la nouvelle protéine catalyse le clivage de l'entérobactine et la libération subséquente du fer nécessaire à une croissance saine. (Remarque :si ces cellules ont été placées sur des boîtes de Pétri avec un minimum de fer, les colonies rouges n'apparaîtraient pas du tout car elles n'auraient pas assez de fer libre pour soutenir la croissance cellulaire.) Crédit :Ann Donnelly/Hecht Lab/Princeton University
Un champ de recherche naissant, biologie artificielle, travaille à la création d'un organisme véritablement nouveau. A Princeton, Le professeur de chimie Michael Hecht et les chercheurs de son laboratoire conçoivent et fabriquent des protéines capables de se replier et d'imiter les processus chimiques qui soutiennent la vie. Leurs protéines artificielles, codées par des gènes synthétiques, ont une longueur d'environ 100 acides aminés, en utilisant un arrangement infiniment variable de 20 acides aminés.
Maintenant, Hecht et ses collègues ont confirmé qu'au moins une de leurs nouvelles protéines peut catalyser des réactions biologiques, ce qui signifie qu'une protéine entièrement conçue à partir de zéro fonctionne dans les cellules comme une véritable enzyme.
Les enzymes sont la clé de toute la biologie, dit Hecht. "La biologie est le système de réactions biochimiques et de catalyseurs. Chaque étape a une enzyme qui la catalyse, car sinon ces réactions n'iraient pas assez vite pour que la vie existe. ... Une enzyme est une protéine qui est un catalyseur. Ce sont les meilleurs catalyseurs de l'univers parce que l'évolution a passé des milliards d'années à les sélectionner. Les enzymes peuvent augmenter la vitesse d'une réaction de plusieurs ordres de grandeur."
Une fois que Hecht et son équipe de recherche ont réussi à créer des protéines artificielles pour E. coli, ils ont commencé à chercher des fonctions critiques qu'ils pourraient perturber dans ces simples bactéries. Ils ont trouvé quatre gènes qui, une fois retiré, rendrait non seulement l'E. coli inerte - effectivement mort - mais que leurs protéines artificielles pourraient alors "sauver, " ou réanimer.
Ils ont identifié ces protéines artificielles pour la première fois en 2011, et ils ont passé les six dernières années à travailler pour comprendre les mécanismes précis par lesquels leurs nouvelles protéines fonctionnaient, maintenant détaillé dans un article du 15 janvier dans Nature Chimie Biologie .
Il est important de ne pas supposer qu'une protéine artificielle fonctionnera de la même manière que la protéine naturelle dont elle sauve la suppression, Hecht a mis en garde.
Déterminer les mécanismes utilisés par leurs protéines artificielles a nécessité d'innombrables expériences. "Nous avons eu quatre délétions de gènes différentes - quatre fonctions enzymatiques différentes, " a déclaré Ann Donnelly, auteur principal sur le papier.
Après des années d'expérimentations, l'équipe avait conclu que deux de ces "sauvetages" opèrent en remplaçant des enzymes - des protéines qui servent à catalyser d'autres réactions, les aidant à fonctionner assez rapidement pour maintenir la vie - avec des protéines qui n'étaient pas des enzymes elles-mêmes, mais qui stimulent la production d'autres processus dans la cellule, elle a dit. Le troisième montrait des progrès, mais le quatrième avait frustré plusieurs chercheurs qui sont passés par le laboratoire de Hecht.
Mais alors Donnelly, qui était une étudiante diplômée lorsqu'elle a fait la recherche et est maintenant spécialiste de la recherche en bioinformatique à l'Université de Pittsburgh, déchiffré le code.
"Cette protéine artificielle, Syn-F4, était en fait une enzyme, " a déclaré Donnelly. "Ce fut un moment incroyable et incroyable pour moi, incroyable au point que je ne voulais rien dire avant de l'avoir répété plusieurs fois."
Elle a seulement dit à Katie Digianantonio, un collègue étudiant diplômé, et Grant Murphy, un chercheur postdoctoral, qui sont co-auteurs du nouveau document. "J'ai dit, "Je pense que c'est une enzyme." Je leur ai montré les données initiales et j'ai dit, « Ne dis rien à Michael. Laisse-moi recommencer." Donnelly a repurifié la protéine, et créé un nouveau, substrat parfaitement pur pour E. coli. « J'ai tout réexécuté à partir de différentes préparations et lorsque le résultat s'est maintenu, J'ai dit à Michael, " elle a dit.
Sur l'ensemble original de protéines qui pourraient sauver des délétions de gènes, c'est le seul qui s'est avéré être une enzyme - du moins jusqu'à présent, elle a dit.
"Nous avons une protéine complètement nouvelle qui est capable de maintenir la vie en étant en fait une enzyme - et c'est juste fou, " a déclaré Hecht.
Cela a des implications importantes pour l'industrie, dit Justin Siegel, directeur de la faculté de l'Institut d'innovation pour l'alimentation et la santé et professeur adjoint de chimie, biochimie et médecine moléculaire à l'UC Davis Genome Center, qui n'a pas participé à la recherche.
"La biotechnologie utilise couramment des enzymes pour réaliser des procédés industriels de production de matériaux, nourriture, carburant et médicaments, " a déclaré Siegel. " L'utilisation de ces enzymes dans un environnement industriel commence souvent avec une enzyme que la nature a évoluée pendant des milliards d'années dans un but sans rapport, puis la protéine est modifiée pour affiner sa fonction pour l'application moderne. Le rapport démontre ici que nous ne sommes plus limités aux protéines produites par la nature, et que nous pouvons développer des protéines - qui auraient normalement mis des milliards d'années à évoluer - en quelques mois. »
L'équipe de Hecht avait créé une souche d'E. coli qui manquait de l'enzyme Fes, sans lequel il ne peut pas accéder au fer nécessaire pour maintenir la vie. "Nous avons tous besoin de fer, " Hecht dit. " Même si le fer est abondant sur terre, le fer biologiquement accessible ne l'est pas. » Les cellules ont développé des molécules comme l'entérobactine, il expliqua, qui peut piéger le fer de n'importe quelle source disponible, mais ils ont alors besoin d'un outil, comme Fès, pour arracher le fer à l'emprise serrée de l'entérobactine.
Cette souche d'E. coli modifiée n'avait aucun moyen d'extraire, ou hydrolyser, le fer de son entérobactine, jusqu'à ce qu'il soit "sauvé" par Syn-F4. Les chercheurs avaient fourni du fer à E. coli, mais cela ne faisait que colorer les cellules en rouge, car bien qu'ils puissent accumuler le métal lié, ils ne pouvaient pas le libérer de l'entérobactine ou y accéder pour une utilisation cellulaire.
"Et puis Ann a remarqué... ils ne sont plus rouges, ils sont blancs, ce qui suggère que les cellules peuvent le décomposer et obtenir le fer, ce qui suggère que nous avons en fait une enzyme !", a déclaré Hecht.
"Des millions d'années d'évolution ont abouti à Fès, une enzyme parfaitement bonne pour hydrolyser l'entérobactine, " a déclaré Wayne Patrick, maître de conférences en biochimie à l'Université d'Otago en Nouvelle-Zélande, qui n'a pas participé à la recherche. "Il est assez facile d'étudier la structure, fonction et mécanisme de Fès, et d'inférer quelque chose sur son évolution en la comparant à des séquences apparentées. Mais il est beaucoup plus difficile (et plus intéressant) de se demander si Fes est la solution au problème biochimique de l'hydrolyse de l'entérobactine ou si c'est l'une des nombreuses solutions. Donnelly et al. ont montré qu'une enzyme qui n'est jamais née (sauf artificiellement, dans leur laboratoire) aurait néanmoins pu être une solution tout aussi bonne (si on lui en avait donné l'occasion).
"Ce raisonnement a plusieurs implications, " expliqua Patrick. " L'un est pour la vie qui reste à découvrir sur Terre. Peut-etre un jour, nous allons trouver une enzyme naturelle qui ressemble à Syn-F4 mais prend la place de Fes dans un micro-organisme ou autre. Au moins maintenant, nous saurons regarder. Une autre implication est pour l'astrobiologie. S'il existe de nombreuses solutions tout aussi probables à un problème biochimique, il devient plus probable qu'une solution ait été trouvée ailleurs dans l'univers."
Les chercheurs sont à l'aube d'une véritable biologie synthétique, dit Hecht.
"E. coli en a 4, 000 gènes différents, " a-t-il dit. " Nous n'avons pas testé les 4, 000, parce que la seule façon dont cette expérience fonctionne est si rien ne pousse sur un support minimal, et du 4, 000, ce n'est vrai que pour certains.
« Nous commençons à coder pour un génome artificiel. Nous avons sauvé 0,1 % du génome d'E. coli. … Pour l'instant, c'est un étrange E. coli avec des gènes artificiels qui lui permettent de se développer. Supposons que vous remplaciez 10 % ou 20 %. Alors ce n'est pas juste un étrange E. coli avec des gènes artificiels, alors il faut dire que c'est un nouvel organisme."