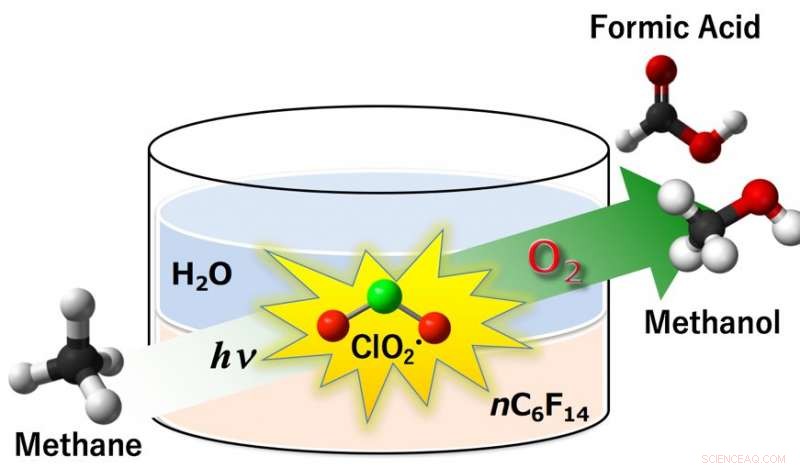
Fig.1 :Le radical dioxyde de chlore (ClO2•) s'est avéré agir comme un agent oxydant efficace dans l'oxygénation aérobie du méthane en méthanol et acide formique sous photoirradiation. Les rendements en méthanol et acide formique étaient de 14 % et 85 %, respectivement, avec une conversion de méthane de 99% aux conditions ambiantes (298 K, 1 atm) dans un système à deux phases comprenant du perfluorohexane et de l'eau. Crédit :Université d'Osaka
Les radicaux libres n'ont pas la meilleure presse. Cependant, alors qu'ils sont connus comme des oxydants nocifs dans le corps, ces produits chimiques ultra-réactifs sont indispensables en laboratoire. Les réactions radicales jouent un rôle dans les technologies clés telles que l'élimination des polluants et le fractionnement de l'eau.
Maintenant, des chercheurs de l'université d'Osaka ont utilisé des radicaux pour transformer un gaz à effet de serre, méthane, en produits chimiques utiles. Poussé par la lumière, ce processus respectueux de l'environnement atteint un objectif qui est resté insaisissable pendant des décennies.
Le méthane (CH4) est apparenté au méthanol et à l'acide formique, dont l'industrie chimique a besoin en grande quantité. Les bactéries peuvent oxyder le CH4 en méthanol presque sans effort en utilisant des enzymes naturelles. La même transformation en labo, cependant, nécessite chimiquement une température élevée, réactifs à haute pression et coûteux pour cliver les liaisons C—H extrêmement fortes. Comme indiqué récemment, le nouveau procédé utilise de puissants radicaux chlorés pour activer ces liaisons. Cela permet à la réaction de se produire à température ambiante, sous la lumière de la lampe, avec de l'oxygène simple comme agent oxydant.
Les radicaux libres sont des produits chimiques avec des électrons non appariés - leur réactivité galopante vient du besoin urgent pour les électrons isolés de trouver des partenaires dans une autre molécule. Dans le processus d'Osaka, le dioxyde de chlorite (ClO2•) est activé sous la photoirradiation pour donner des radicaux chlore (Cl•) et de l'oxygène singulet. Le radical hautement réactif, Cl•, puis extrait un atome d'hydrogène de CH4 pour donner des radicaux méthyle, CH3•, qui à leur tour réagissent avec l'oxygène pour produire du méthanol et de l'acide formique précieux. Ce processus apparemment simple, cependant, repose sur une touche de conception subtile.
"L'activation du méthane par des espèces radicalaires a déjà été essayée, " étudie un auteur principal, le professeur Kei Ohkubo. " Cependant, Les intermédiaires CH3• ont tendance à réagir avec le solvant organique hydrocarboné, ce qui entraîne la désactivation des intermédiaires radicalaires réactifs. Cela ne se produit pas dans l'eau, mais malheureusement, le méthane se dissout à peine dans l'eau. » Les chercheurs ont trouvé un moyen de contourner cela :deux solvants dans un seul système, un pour chaque étape du processus. La formation initiale de ClO2• se produit en phase aqueuse, où le chlorite de sodium est soluble. Puis, Le ClO2• passe à une phase perfluorohexane (PFH), où le méthane et l'O2 se dissolvent pour réagir avec eux.
« Le PFH est idéal pour la deuxième étape :il dissout le méthane, mais ne réagit pas avec les radicaux CH3•, " explique Ohkubo. " Cela crée un espace pour l'oxydation du CH3•, donner les produits désirés. Puis, après formation du méthanol et de l'acide formique, ils traversent la frontière du solvant en sens inverse, dans la phase aqueuse. Ici, ils sont protégés contre une oxydation supplémentaire en CO ou CO2 indésirable sous forme de gaz à effet de serre. »
Le processus complet est d'une efficacité impressionnante, convertir plus de 99% du méthane dans les produits cibles, sans avoir besoin d'une température ou d'une pression élevées.
"C'est la première utilisation réussie de l'oxygène de l'air pour oxyder le méthane dans des conditions ambiantes, " Ohkubo dit. " Les méthodes énergivores pour la production chimique doivent être éliminées - nous avons un besoin urgent de solutions intelligentes pour traiter les matières premières de manière douce, manière respectueuse de l'environnement. Notre étude montre comment cela peut être fait pour le méthane. Le concept de solvant à deux phases, où les intermédiaires instables sont protégés par un solvant tel que le PFH, pourrait potentiellement être étendu à l'ensemble de l'industrie.