
Crédit :Université de Leyde
Après près de quatre décennies, Les chimistes de Leiden et Eindhoven ont résolu la discussion sur le modèle correct concernant la réaction chimique la plus simple en catalyse hétérogène, ce qui est essentiel pour les piles à combustible. En utilisant une surface de platine incurvée unique, Ludo Juurlink et Ph.D. le candidat Richard van Lent de Leiden et Michael Gleeson de DIFFER ont montré quel modèle décrit correctement la réaction de l'hydrogène. Ils ont publié leurs conclusions dans Science le 11 janvier.
Depuis près de quatre décennies, il y a eu un débat houleux dans la littérature chimique :lequel des deux modèles existants pour la réaction de l'hydrogène à un catalyseur au platine est correct (voir encadré) ? Les méthodes traditionnelles n'étaient pas suffisantes pour le prouver. Le chimiste de Leiden Ludo Juurlink et Michael Gleeson du Dutch Institute for Fundamental Energy Research (DIFFER) ont décidé de développer une nouvelle méthode pour fournir des preuves concluantes, qui s'est avéré être un succès.
Les deux modèles existants pour la catalyse hétérogène donnent des prédictions différentes sur la façon dont la réaction de l'hydrogène dépend de la structure de la surface du platine. Au moyen de mesures, les chercheurs pourraient déterminer la réactivité de l'hydrogène et ainsi prouver quel modèle est correct. Le cristal de platine incurvé était crucial pour cela, qui a été fabriqué par la société néerlandaise à Zaandam pour la première fois. "Parce que la surface du platine est courbée, la structure atomique change très progressivement le long de la surface, " explique Juurlink. " Vous pouvez comparer cette structure à un escalier, dont les marches vers les bords deviennent de plus en plus étroites. Au milieu, cela ressemble plus à une salle de bal." Il s'est avéré que la réactivité de l'hydrogène dépendait linéairement de la proximité des marches les unes par rapport aux autres. Plus les marches étaient éloignées, l'hydrogène le moins réactif était. "Et donc le modèle qui a prédit un comportement non linéaire est incorrect, " il dit.
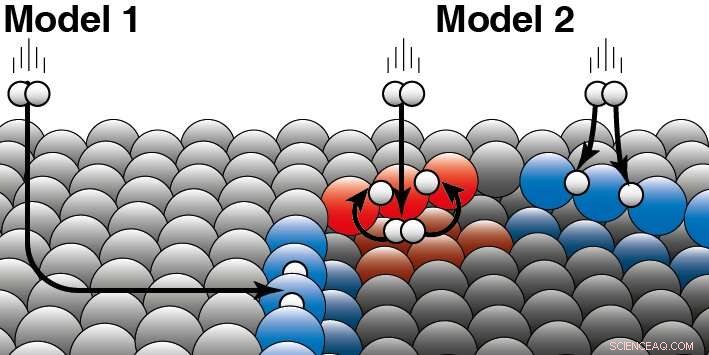
Un catalyseur accélère une réaction chimique sans être consommé. En catalyse hétérogène, le catalyseur est généralement un solide et les réactifs un gaz ou un liquide. Juurlink explique la différence entre les deux modèles :"Les deux modèles sont basés sur des hypothèses différentes sur la façon dont l'énergie cinétique de la molécule d'hydrogène "s'échappe" lors de la collision avec la surface du platine." Pour clarifier cela, il donne un exemple :« Si un chien est dans un trou de glace, il s'est peut-être retrouvé là de deux manières. Soit il a glissé sur la glace par le côté et est tombé dans le trou de glace, ou il a sauté directement dans le trou de glace par le côté. Leurs recherches montrent maintenant que les molécules d'hydrogène réagissent principalement directement hors de la phase gazeuse au bord de la marche du platine (modèle 2). Modèle 1, cela suppose que la plupart des molécules finissent sur les bords en « patinant » sur la surface plane du platine et réagissent alors seulement n'est donc pas correct. Les chercheurs ont constaté des différences entre les deux types de bords (rouge et bleu) qui se produisent naturellement sur les catalyseurs au platine. L'hydrogène peut atterrir sur le haut ou le bas d'un tel bord. Pour les deux types de bords de marche, les chercheurs sont en mesure de décider quelle partie réagit directement sur la face supérieure (comme illustré en bleu) ou atterrit en premier sur la face inférieure (comme en rouge). Crédit :Université de Leyde
La recherche a été menée sous ultra-vide et fournit des informations importantes. « Nous savons maintenant mieux calculer la vitesse des réactions chimiques - l'un des modèles n'y contribue pas de manière significative, " dit Juurlink. " De plus, nous savons maintenant que ces surfaces de cristal incurvées offrent un nouvelle opportunité d'apprendre comment les réactions chimiques se produisent réellement sur les surfaces. Nous allons certainement faire plus de recherches avec cela. »
Presque tous les grands procédés industriels chimiques utilisent la catalyse hétérogène. Les catalyseurs sont parfois chers et rares, comme le platine, un catalyseur commun trouvé dans les piles à combustible et les systèmes d'échappement des voitures. "Ce qui est inhabituel, c'est que nous ne savons généralement même pas vraiment comment et pourquoi de tels catalyseurs accélèrent les réactions chimiques, " dit Juurlink. Une meilleure compréhension de ce comment et pourquoi contribuera à rendre l'industrie chimique plus durable. " Sur la base d'une meilleure compréhension de ce qui se passe au niveau atomique, nous pouvons développer de nouveaux catalyseurs, " dit Juurlink. " Des catalyseurs qui causent moins de pertes d'énergie et sont moins dépendants de matériaux chers et rares. "