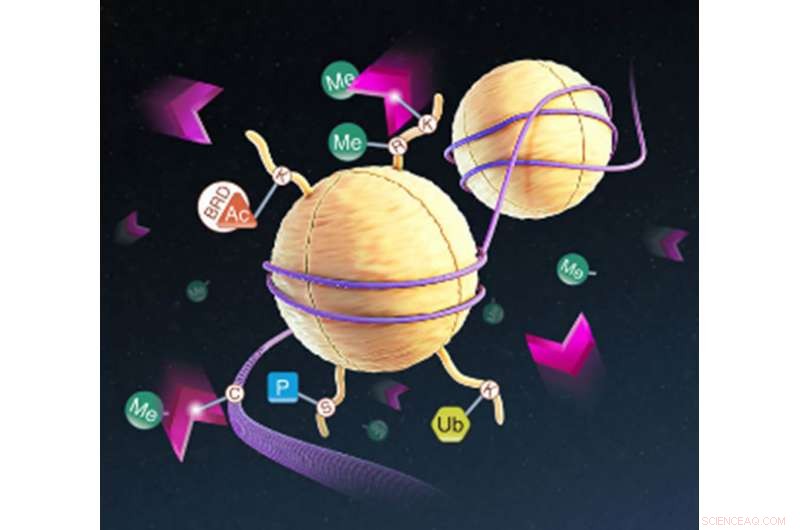
Déméthylation de l'ADN et de l'histone dans le nucléosome par les déméthylases. Crédit :Promega Corporation
Un nouvel article de recherche original (et disponible gratuitement) publié avant impression sur Découverte SLAS Online décrit une nouvelle méthodologie qui permet l'étude d'un grand nombre d'enzymes structurellement conservées appartenant à la superfamille des dioxygénases dépendantes du Fe(II)/2-oxoglutarate. Cette superfamille comprend environ 60 enzymes responsables de la régulation d'un grand nombre de processus biologiques, notamment la régulation épigénétique, Réparation d'ADN/ARN et détection d'oxygène. Parmi ceux-ci, Les histone lysine déméthylases JumonjiC (JMJC) et les prolyl hydroxylases sont des cibles potentielles de médicaments en raison de leur pertinence pour les maladies humaines.
Le succinate est un produit commun à toutes les réactions de dioxygénase dépendantes du Fe(II)/2-oxoglutarate. Un nouveau test homogène d'Alves et al. de Promega Corporation (Madison, WI) détecte le succinate par luminescence. Ce test permet aux scientifiques de caractériser l'activité biochimique de pratiquement n'importe quelle enzyme qui produit du succinate, quelle que soit la structure chimique du substrat. Cela démontre l'universalité du test et ses avantages par rapport aux tests qui dépendent généralement de la modification ou du marquage du substrat ou du réactif nécessaire pour capturer ou surveiller le produit.
Les auteurs présentent un éventail d'applications de leur méthode. En utilisant un format miniaturisé, ils caractérisent l'activité enzymatique de plusieurs JumonjiC histone déméthylases et autres dioxygénases, pour lesquels les méthodes de criblage à haut débit ne sont actuellement pas disponibles. En utilisant ce test de détection de succinate simple, les auteurs étudient les spécificités du substrat et déterminent les paramètres cinétiques apparents pour différentes enzymes. Ils valident également la méthode en tant qu'outil de criblage d'inhibiteurs à l'aide de la bibliothèque de composés LOPAC 1280 et étudient le mode d'action de hits sélectionnés contre les membres de cette famille d'enzymes.
La détection bioluminescente du succinate est résistante aux interférences chimiques et elle est efficace pour caractériser plusieurs dioxygénases dépendantes du Fe(II)/2-oxoglutarate avec diverses structures de substrat dans un format unique. En étudiant un grand nombre de ces enzymes, cette méthode pourrait avoir un impact significatif sur le domaine de la recherche sur les dioxygénases.