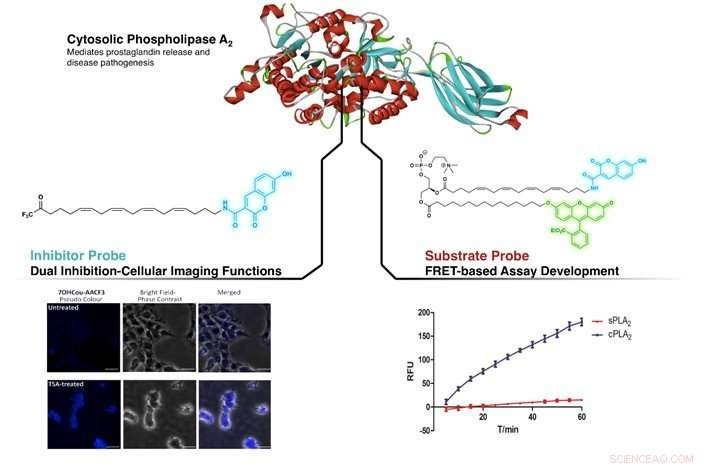
La figure montre le ciblage de cPLA2 par l'inhibiteur nouvellement conçu et la sonde substrat. Gauche : Identification des différences de niveau de cPLA2 chez les patients non traités et la trichostatine A (TSA, un composé inhibiteur) des cellules SHSY5Y traitées. À droite :démonstration d'une sélectivité plus élevée pour cPLA2 contre sPLA2 (un autre membre de la famille des phospholipases A2) par un test basé sur FRET en utilisant la sonde de substrat. Crédit :NG Cheng Yang, CAO Xujun
Les chimistes de NUS ont récemment développé des sondes sélectives pour la phospholipase cytosolique A2 (cPLA2) afin de déterminer les niveaux et l'activité des enzymes.
cPLA2 est une enzyme importante fortement utilisée dans la régulation des réponses inflammatoires dans le corps. Il a suscité un intérêt important sur le plan médical, avec des liens croissants de son implication dans les maladies inflammatoires et neurologiques telles que la maladie d'Alzheimer et la sclérose en plaques. La capacité d'imager et d'identifier correctement la cPLA2 dans les systèmes biologiques est importante pour comprendre les voies mécanistiques impliquées dans ces maladies. Une équipe dirigée par le Pr LAM Yulin du Département de Chimie, NUS a découvert des composés fluorescents qui pourraient imager cPLA2. Ceux-ci comprennent un inhibiteur (composé qui réduit l'activité enzymatique) et un substrat (composé sur lequel l'enzyme agit) qui présentent une fluorescence.
En imitant la structure d'un inhibiteur bien connu de cPLA2, arachidonyl trifluorométhyl cétone (AACOCF3), le groupe de recherche a réussi à attacher un colorant organique fluorescent (coumarine) à l'extrémité de la chaîne carbonée de l'AACOCF3. Cela a créé une forme fluorogène d'AACOCF3 qui a conservé son activité inhibitrice native vis-à-vis de cPLA2. Des études préliminaires réalisées sur le composé nouvellement conçu ont montré sa capacité à différencier les cellules contenant différents niveaux de cPLA2. Parallèlement, cette sonde nouvellement développée a pu inhiber cPLA2, assurant un double rôle d'imagerie et d'inhibition. Cela permet aux biochimistes de détecter directement l'enzyme au niveau cellulaire tout en effectuant une réponse biologique prévue.
Encouragé par ces résultats, le groupe de recherche a élargi ses études en développant une autre sonde pour mesurer l'activité cPLA2. Le dosage classique de l'activité cPLA2 utilise un composé radioactif comme substrat. Cependant, l'utilisation de tels dosages est hautement indésirable en raison des dangers entourant les matières radioactives. Pour contourner ce problème, divers kits d'essais calorimétriques et fluorogènes pour la mesure de l'activité cPLA2 sont maintenant disponibles dans le commerce. Cependant, ces tests peuvent également détecter d'autres enzymes de la famille PLA2 et ne sont pas sélectifs uniquement pour cPLA2. Il serait utile d'avoir une sonde alternative, qui est spécifiquement ciblé sur cPLA2.
En adoptant une approche similaire, Des fragments de coumarine fluorogène et de fluorescéine (un autre colorant organique fluorescent) ont été fixés sur de la phosphatidylcholine (un substrat de cPLA2). Ceci provoque un transfert d'énergie interne non radiatif entre un colorant à l'autre lorsque la partie photosensible est irradiée à sa longueur d'onde d'excitation; un phénomène connu sous le nom de transfert d'énergie de résonance de Förster (FRET). Cette nouvelle sonde substrat s'est avérée hautement sélective vis-à-vis de cPLA2, sans perte d'activité native et adapté aux tests de criblage d'inhibiteurs.
Le groupe étudie actuellement les effets de la fixation de composés chimiques fluorescents de différentes couleurs sur les sondes inhibiteur et substrat afin d'élargir leurs applications.