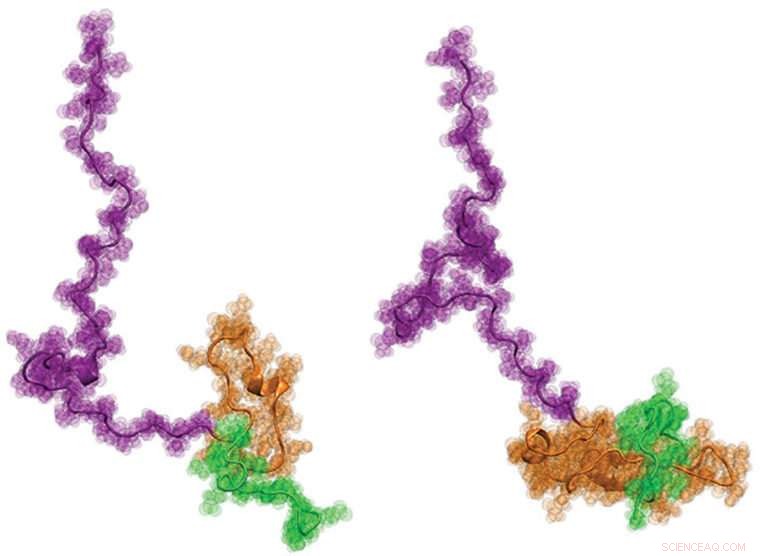
Une cohorte internationale de scientifiques, dont des ingénieurs de l'Université de Washington à St. Louis, récemment visualisé la protéine de Huntington pour la première fois. On espère qu'en savoir plus sur la structure - qui a une forme de têtard - pourrait aider à mieux informer le développement de nouvelles thérapies pour la maladie. Crédit :Washington University à St. Louis
La maladie de Huntington est une maladie évolutive, maladie neurodégénérative mortelle causée par des mutations dans un gène spécifique appelé huntingtine (Htt). Au cours des 20 années et plus depuis que le gène Htt a été identifié, les chercheurs se sont concentrés sur la protéine codée par le gène Htt, appelé Httex1. Cette protéine s'accumule dans le cerveau des patients atteints de la maladie de Huntington, et l'hypothèse dominante a été qu'il subit un changement structurel dramatique lorsqu'un tractus répétitif de l'acide aminé glutamine mute en une région anormalement longue connue sous le nom de tractus polyglutamine (polyQ) expansé par mutation.
Maintenant, pour la première fois, l'équipe de Hilal A. Lashuel à l'École Polytechnique Fédérale de Lausanne (EPFL) en Suisse; Edward A. Lemke au Laboratoire européen de biologie moléculaire (EMBL) en Allemagne; et Rohit V. Pappu de l'Université de Washington à St. Louis a découvert une description structurelle détaillée de Htt en fonction de la longueur du polyQ. L'ouvrage a été publié récemment dans le Journal de l'American Chemical Society .
Une étude en trois étapes
La sécurisation des descriptions structurelles au niveau atomique des fragments de protéines Htt pleine longueur et pertinents pour la maladie, appelés Httex1, a été difficile car ces molécules se collent les unes aux autres et inhibent la génération d'échantillons de protéines pures pour les études structurelles. « Il est très difficile d'obtenir une caractérisation structurale des protéines au sein d'une bouillie, " dit Pappu, le professeur d'ingénierie Edwin H. Murty à la School of Engineering &Applied Science.
"Notre objectif était de comprendre comment l'augmentation de la longueur de la répétition de la queue polyQ modifie la structure de cette protéine au niveau du monomère et dans des conditions où nous sommes capables de dissocier son repliement et son auto-assemblage, " dit Lashuel, professeur de sciences de la vie et directeur du laboratoire de biologie chimique de la neurodégénérescence à l'EPFL.
Dans la première étape de l'étude, Lashuel et le boursier postdoctoral John B. Warner IV ont utilisé de nouvelles stratégies chimiques dans leur laboratoire pour produire des échantillons de haute pureté de Htt pour la spectroscopie moléculaire. Mais ceux-ci ne sont venus qu'en concentrations ultra-faibles et ont nécessité des techniques qui sondent des molécules individuelles. Warner et Lashuel ont permis ces expériences en générant des échantillons avec des marqueurs fluorescents spécifiques au site.
Pour la deuxième étape du projet, Warner et Lashuel ont travaillé avec le laboratoire de Lemke à l'EMBL pour effectuer un transfert d'énergie de résonance Förster (ou fluorescence) à molécule unique (smFRET), qui est une technique qui peut mesurer des distances comprises entre 1 et 10 nanomètres au sein de molécules individuelles - dans ce cas, au sein des protéines Htt individuelles. Cette partie de l'étude a donné la première évaluation quantitative de la façon dont les distances inter-atomiques dans Httex1 varient avec les mutations d'expansion.