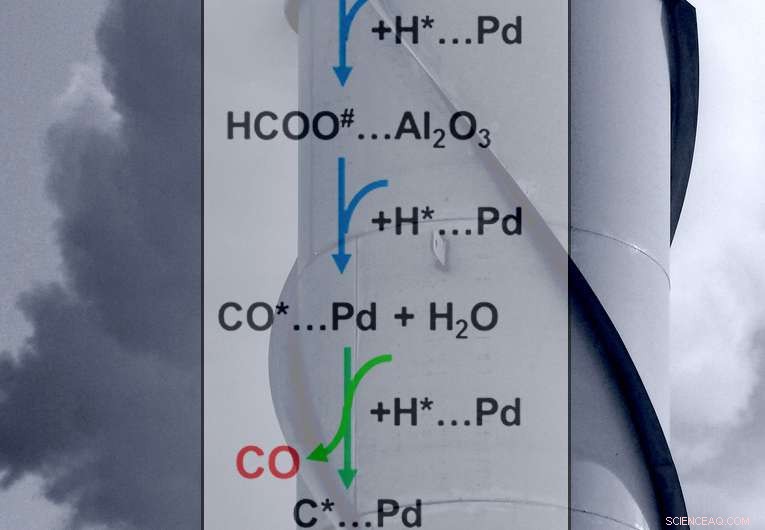
Les flèches vertes montrent l'étape charnière dans le contrôle des produits finaux des réactions :le méthane ou le monoxyde de carbone. Crédit :Scott Butner
Et si nous pouvions transformer le dioxyde de carbone, CO2, en une ressource précieuse ? L'utilisation du CO2 comme matière première pour créer des carburants ou d'autres produits chimiques offrirait des avantages économiques et environnementaux. Le défi consiste à concevoir des procédés efficaces qui ne produisent que le produit chimique souhaité :du méthane ou du monoxyde de carbone. Pourquoi? Les scientifiques n'avaient pas une compréhension claire des étapes cruciales du mécanisme de réaction. Les scientifiques du Pacific Northwest National Laboratory, dirigé par le Dr Janos Szanyi, déterminé que le formiate (HCOO-), un ion souvent négligé, était un intermédiaire essentiel dans le processus global de conversion du CO2. L'équilibre des taux de conversion des intermédiaires de formiate et de monoxyde de carbone détermine les produits chimiques produits.
"Cette étude nous donne des informations cruciales pour utiliser une matière première facilement disponible, CO2, et le transformer en quelque chose d'utile - un intermédiaire chimique, monoxyde de carbone, ou un vecteur énergétique, méthane. Cet intermédiaire peut être utilisé pour la production d'hydrocarbures supérieurs, ou des carburants, " dit Szanyi.
Pendant des années, certains considéraient le formate comme un simple spectateur, une molécule qui n'a pas contribué à la réaction. Maintenant, l'équipe a montré que le formate est en effet vital. Comprendre les étapes, et le rôle des formiates, permet aux scientifiques de concevoir un catalyseur sélectif qui pompe les produits chimiques souhaités. Comprendre les étapes de la réaction donne aux scientifiques des informations cruciales pour contrôler la réaction. Plus loin, l'ouvrage met fin à une controverse de longue date sur le rôle des formiates à la surface du catalyseur.
Dans cette étude, une équipe du Pacific Northwest National Laboratory a déterminé les facteurs qui contrôlent la sélectivité d'un catalyseur pour l'hydrogénation du CO2 en monoxyde de carbone ou en méthane. Ils ont utilisé une nouvelle combinaison d'expériences FTIR par transmission d'opérandes et SSITKA (spectroscopie infrarouge à transformation de Fourier/analyse cinétique transitoire isotopique à l'état stable).
Ils ont déterminé le comportement d'intermédiaires clés (formiates et monoxyde de carbone) à la surface du catalyseur. Pour la formation de monoxyde de carbone, l'étape déterminante est la conversion, ou réduction, de formiate adsorbé à l'interface du catalyseur palladium métallique et du support d'oxyde d'aluminium. Pour la formation de méthane, l'étape déterminante de la vitesse (voir les flèches vertes sur la figure) consiste à ajouter de l'hydrogène au monoxyde de carbone adsorbé. L'équilibre entre les taux de réduction du formiate absorbé et de méthanation du monoxyde de carbone régit la sélectivité du catalyseur. C'est-à-dire, la sélectivité tourne autour de la vitesse à laquelle les intermédiaires en surface captent l'hydrogène, créant soit du monoxyde de carbone soit du méthane.
Après avoir déterminé les aspects clés de la réaction, l'équipe a conçu trois catalyseurs avec différentes distributions de palladium. La quantité de palladium à la surface, ils ont trouvé, est un autre aspect essentiel dans la sélection des produits. Le catalyseur le moins palladium produit à la fois du monoxyde de carbone et du méthane, avec une plus grande sélectivité pour le monoxyde de carbone. En revanche, une sélectivité supérieure à 80 pour cent vis-à-vis de la formation de méthane a été observée sur le catalyseur avec la charge de métal la plus élevée.
L'équipe modifie maintenant l'environnement autour du site actif du catalyseur pour régler sa sélectivité. Ce travail vise à réduire la quantité de produits indésirables libérés. En outre, l'équipe développe des méthodes pour préparer des catalyseurs à atome unique afin d'augmenter l'efficacité des métaux précieux impliqués.