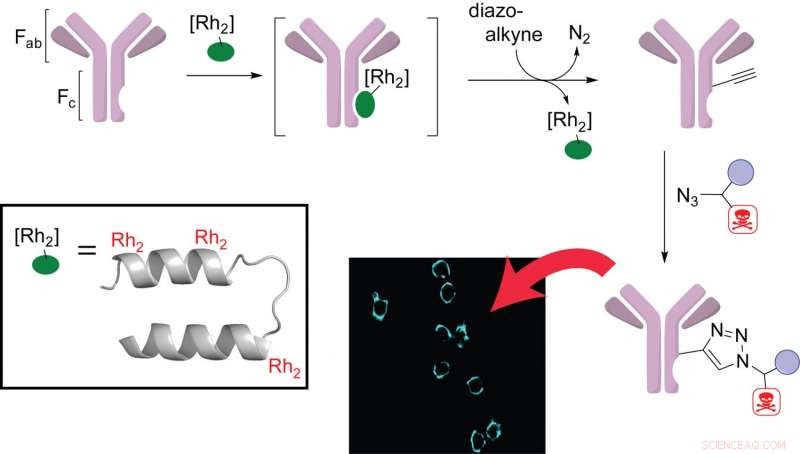
Les chimistes de l'Université Rice ont conçu une métalloprotéine enfichable pour simplifier la tâche de fabrication de thérapies ciblées par anticorps. Les chercheurs ont utilisé un peptide triple métallé (en médaillon) pour donner une fonction spécifique aux anticorps (violet) avec une ogive thérapeutique. Les anticorps modifiés ciblaient sélectivement la surface des cellules cancéreuses du sein en laboratoire (image). Crédit :Ball Research Group/Rice University
Les scientifiques de l'Université Rice ont développé une méthode pour modifier efficacement les anticorps naturels qui peuvent délivrer des médicaments aux cellules cibles. L'ajout d'un peu de métal supplémentaire est la clé.
Le chimiste du riz Zachary Ball et l'étudiant diplômé et auteur principal Jun Ohata ont découvert que le rhodium, un métal de transition rare, peut être un élément utile dans la conception et la préparation de conjugués anticorps-médicaments (traitements) qui sont devenus un outil standard pour l'administration ciblée de médicaments tels que la chimiothérapie.
Ils ont développé une protéine multimétallique unique qui agit comme une enzyme pour catalyser l'action d'une grande variété d'anticorps. Le processus simple permettra aux laboratoires de tester la fonction relative d'une variété de sources d'anticorps et de cibles d'antigène pour voir laquelle fonctionnera le mieux sur une cellule tumorale.
La recherche apparaît dans le Journal de l'American Chemical Society .
La clé de la conception de Ball et Ohata est d'avoir trois complexes de rhodium attachés à des sites spécifiques d'une protéine qui se lie à la région d'anticorps constante (Fc). Une fois lié, ce peptide multimétallique catalyse la fixation spécifique au site d'agents thérapeutiques avec une perturbation minimale de l'anticorps lui-même. Le laboratoire a testé ses complexes sur des cellules cancéreuses du sein et a confirmé que les anticorps modifiés conservaient leurs propriétés de liaison à l'antigène.
"La beauté de ce catalyseur est qu'il se lie à la région constante de l'anticorps, il devrait donc être largement général pour tous les anticorps humains, " dit Boule, professeur agrégé de chimie et directeur du Rice's Institute of Biosciences and Bioengineering. "Nous avons un seul, système de cassette universel qui se branche sur les anticorps pour fabriquer des conjugués médicamenteux assez rapidement et facilement. »

Jun Ohata, étudiant diplômé de l'Université Rice, transfère un échantillon d'une protéine multimétallique. La protéine plug-in est conçue pour simplifier la tâche de fabrication de thérapies ciblées par anticorps. Crédit :Jeff Fitlow/Université Rice
La technique vise à simplifier ce qui a été un chemin compliqué vers les conjugués anticorps-médicaments. "Faire de la chimie sélective sur des anticorps naturels sans d'abord modifier leurs séquences a été un problème non résolu, " a déclaré Ball. " La conjugaison purement aléatoire peut être précieuse, mais il est difficile de comprendre les relations structure-activité quand vous n'avez pas une structure unique; vous obtenez un ensemble de molécules avec un ensemble de propriétés. » Il a déclaré que les conjugués homogènes sont également plus souhaitables d'un point de vue réglementaire.
Son laboratoire possède une vaste expérience de l'interaction des protéines et des métaux de transition, un groupe d'éléments au centre du tableau périodique, dont le rhodium, avec une réactivité chimique diversifiée.
Les complexes de rhodium dans la métalloprotéine de Ball et Ohata jouent plusieurs rôles. "Au moins un des complexes du rhodium se lie et aide à orienter correctement le système, et un deuxième fait la chimie de formation de liaison, " dit Ball.
"C'est juste un problème chimique fascinant, " a-t-il déclaré. " Nous avons résolu de nombreux problèmes de sélectivité des petites molécules, mais quand les chimistes passent à des systèmes de plus en plus gros, les approches traditionnelles ne suffisent pas.
"Nos études dans le passé se sont concentrées sur la chimie pour mettre quelque chose sur les protéines, mais ici, nous avons dû utiliser les protéines produites dans d'autres études biologiques, ce que nous n'avions jamais essayé de faire auparavant, " Ohata a déclaré. " Il m'a fallu près de deux ans pour terminer ces expériences liées à la biologie. "
"Nous considérons cela comme la frontière de la sélectivité chimique, " a déclaré Ball. "Nous avons cette molécule massive qui pèse 150, 000 kilodaltons. Comment trouver un groupe hydroxyle dans cette structure massive et faire de la chimie dessus ? C'est le genre de choses fondamentales auxquelles les chimistes aiment penser."
Le laboratoire de Ball commence à travailler avec des collaborateurs du Texas Medical Center pour tester le nouveau catalyseur. « Nous voulons les mettre entre les mains des cliniciens et des personnes chargées du développement de médicaments pour voir ce que ces conjugués peuvent faire, " il a dit.