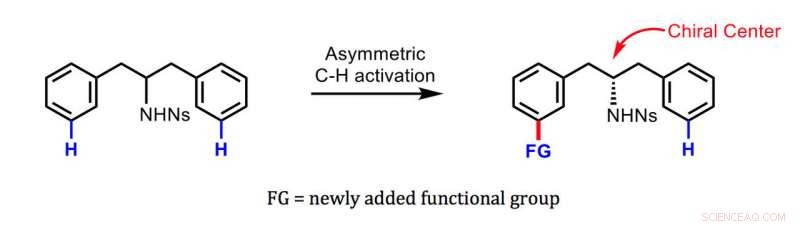
La nouvelle méthode développée par Yu et ses collègues. Crédit :Jin-Quan Yu/Recherche Scripps
Les chimistes de Scripps Research ont relevé l'un des défis les plus redoutables de la chimie de synthèse en inventant une méthode pour "l'activation énantiosélective à distance du méta-CH, " qui permet de fabriquer des molécules chirales jusqu'alors difficiles voire impossibles à synthétiser.
La méthode, rapporté aujourd'hui dans La nature , est susceptible d'être largement adopté pour la fabrication de médicaments potentiels et d'autres produits chimiques.
"Cette nouvelle méthode devrait nous permettre d'explorer un grand 'espace chimique' qui était essentiellement interdit, " dit Jin-Quan Yu, Doctorat., chercheur principal et professeur de chimie Frank et Bertha Hupp à Scripps Research.
Les molécules chirales sont asymétriques, avec les formulaires "main droite" et "main gauche". Souvent, une seule de ces formes (appelée énantiomères) a l'activité biologique ou chimique souhaitée, tandis que l'autre est inerte ou a même des effets secondaires indésirables - et la plupart des réactions ordinaires produisent un produit impur, 50:50 mélange des deux.
Il existe des méthodes pour transformer une molécule symétrique en une molécule chirale et obtenir des quantités pures d'un énantiomère plutôt que de l'autre. Cependant, ces méthodes impliquent généralement la fixation d'un amas réactif d'atomes appelé groupe fonctionnel à la molécule de départ au point qui devient le centre de l'asymétrie :le centre dit chiral. La nouvelle méthode attache un nouveau groupe fonctionnel relativement loin du centre chiral, un exploit qui n'était auparavant réalisable que par des enzymes dans des cellules vivantes. Étant donné que le centre chiral contient généralement un autre groupe fonctionnel, la molécule chirale résultante se termine par deux groupes fonctionnels largement espacés, conférant potentiellement une bioactivité unique et puissante.
"Les molécules chirales que nous pouvons fabriquer avec cette méthode peuvent être conçues pour interagir avec des sites de liaison largement espacés sur une protéine cible, par exemple, " dit Yu.
La clé de la nouvelle méthode est une molécule auxiliaire spécialement conçue, un "médiateur chiral transitoire, " basé sur le composé organique norbornène. Il permet l'étape cruciale d'attacher le nouveau groupe fonctionnel de manière asymétrique à un composé de départ initialement symétrique - loin du centre chiral sur le squelette moléculaire mais, Toutefois, produisant près de 100 pour cent de quantités pures de l'énantiomère souhaité.
L'équipe de Yu a démontré la technique en l'utilisant pour "l'induction chirale à distance" des benzylamines et des phényléthylamines, de larges classes de molécules qui forment les bases de nombreux médicaments modernes ainsi que de nombreux composés biologiquement actifs dans les cellules végétales et animales. Les molécules chirales résultantes comprenaient typiquement plus de 95 pour cent de l'énantiomère souhaité et moins de 5 pour cent de l'énantiomère indésirable.
Yu et son groupe explorent actuellement les moyens d'élargir la portée de cette stratégie à d'autres classes de molécules de départ. Ils utilisent également leur nouvelle méthode pour créer de grandes bibliothèques de composés auparavant inaccessibles, qui peuvent être criblés pour découvrir de nouveaux médicaments potentiels.