Figure 1. La structure en forme de ruban du complexe photosystème II (PDB ID :3ARC). Crédit :Université de Kobe
La photosynthèse nécessite un mécanisme pour produire de grandes quantités d'énergie chimique sans perdre le pouvoir oxydant nécessaire pour décomposer l'eau. Une équipe de recherche japonaise a clarifié une partie de ce mécanisme, marquant une nouvelle étape vers le développement potentiel de la photosynthèse artificielle. Les résultats ont été publiés le 27 février dans l'édition en ligne du Journal des lettres de chimie physique .
L'équipe était dirigée par le professeur KOBORI Yasuhiro (Centre de recherche en photoscience moléculaire de l'Université de Kobe) et le doctorant HASEGAWA Masashi (École supérieure des sciences) avec le professeur agrégé MINO Hiroyuki (École supérieure des sciences de l'Université de Nagoya).
Au cours de la réaction de séparation de l'eau dans la photosynthèse, les plantes produisent de l'oxygène en convertissant l'énergie solaire en énergie chimique, fournissant la source d'énergie nécessaire à leur survie. Cette réaction est réalisée par un complexe protéique dans les chloroplastes (situés dans les feuilles) appelé complexe photosystème II (voir figure 1).
En 2015, l'équipe de recherche du professeur Kobori a réussi à analyser les interactions électroniques et le placement tridimensionnel de la séparation de charge initiale produite directement après la photoréaction dans le centre de réaction photosynthétique des bactéries violettes, qui ne provoquent pas le potentiel d'oxydation pour la division de l'eau. Cependant, dans le complexe photosystème II pour les plantes supérieures, la configuration de l'état initial de séparation des charges n'était pas claire, et c'était un mystère de savoir comment cela a conduit à une réaction efficace de séparation de l'eau tout en conservant le pouvoir oxydant élevé.
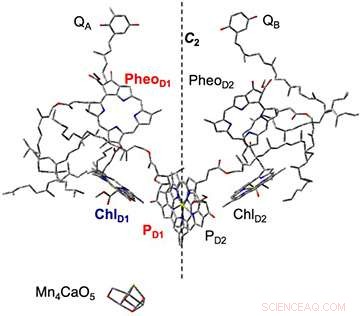
Figure 2. La composition des molécules de pigment au centre de la réaction complexe du photosystème II, clarifié par analyse structurale aux rayons X. Sur la base du processus initial de séparation des charges, une charge négative apparaît dans la phéophytine (PheoD1) et une charge positive dans la chlorophylle (PD1). Cette fois, la plastoquinone (QA, QB) a été pré-réduit :les échantillons de membrane thylacoïdienne dans lesquels le transfert d'électrons de la phéophytine avait été suspendu ont été irradiés, et l'état de séparation de charge (PheoD1-・ PD1+・) a été capturé. Mn4CaO5 est oxydé à partir de PD1+・ et sert de catalyseur pour la séparation de l'eau. Crédit :Université de Kobe
Les scientifiques ont extrait des membranes thylakoïdes (où se déroule la photoréaction lors de la photosynthèse) des épinards, ajouté un agent réducteur, et irradié les échantillons. Cela leur a permis de détecter des signaux micro-ondes à partir de l'état de séparation de charge initial à un degré de précision d'un 10 millionième de seconde (voir figure 3a). Ils ont développé une méthode d'analyse des signaux micro-ondes en utilisant l'imagerie à polarisation de spin. Pour la première fois, il a été possible d'effectuer une analyse de vue en 3D de la configuration de la charge électrique produite directement après l'exposition à la lumière en tant qu'intermédiaire réactif. Cela a été fait avec une précision au 10 millionième de seconde près, comme photographie consécutive (voir figure 3b). Sur la base de cette visualisation, ils ont également quantifié l'interaction électronique qui se produit lorsque les orbites des électrons se chevauchent pour des molécules avec des charges électriques (figure 3c).
La structure initiale de séparation des charges électriques clarifiée par cette analyse n'était pas très différente de la structure avant la réaction, mais l'analyse d'imagerie a montré que la charge électrique positive qui s'est produite dans le pigment en tant qu'intermédiaire réactif existait de manière disproportionnée dans les molécules simples de chlorophylle (figure 3b, c). Cela suggère qu'il y a une forte stabilisation causée par l'interaction électrostatique entre les charges.
Il a été révélé que le retour de la charge négative est supprimé, puisque le chevauchement entre les orbites des électrons est fortement limité par l'effet isolant de l'extrémité du groupe vinyle. Cela signifie qu'il devient possible d'utiliser les hauts pouvoirs oxydants de la charge positive de la chlorophylle (PD1) pour la décomposition oxydante ultérieure de l'eau.
Sur la base de ces constatations, les chercheurs ont déverrouillé une partie du mécanisme pour produire efficacement de grandes quantités d'énergie chimique sans perte du pouvoir oxydant nécessaire pour diviser l'eau lors de la photosynthèse. Ces découvertes pourraient aider à concevoir un "système de photosynthèse artificielle" qui peut fournir une source d'énergie propre en convertissant efficacement l'énergie solaire en grandes quantités d'électricité et d'hydrogène. L'application de ce principe pourrait contribuer à résoudre les problèmes énergétiques, l'environnement et les pénuries alimentaires.
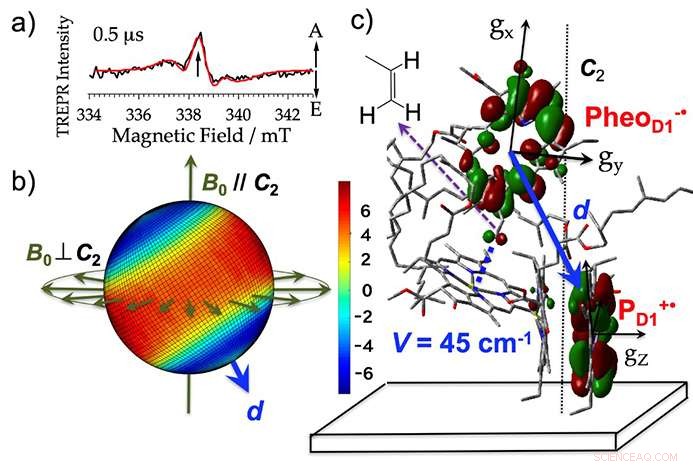
Figure 3. a) Le spectre du complexe photosystème II obtenu en utilisant la résonance paramagnétique électronique résolue en temps (TREPR). A et E montrent les signaux hyperfréquences d'absorption et d'émission (polarisation de spin électronique). b) L'imagerie 3D de (a) la polarisation du spin des électrons mappée dans toutes les directions de champ magnétique possibles à une intensité de champ magnétique de résonance de 338,3 mT. Le rouge et le bleu affichent respectivement la force de l'absorption et de l'émission des micro-ondes. Pour les échantillons où le film est aligné avec l'axe de la membrane thylacoïdienne, le signal change obtenu lorsque les directions du champ magnétique externe (B0) par rapport à la direction normale du plan du film (C2) sont parallèles (B0//C2) et perpendiculaires (B0⊥C2) supportent cette imagerie tridimensionnelle. d montre le vecteur directionnel qui relie les charges électriques. c) Le placement en orbite de l'état initial de séparation des charges électriques (PheoD1-・PD1+・) dans le centre de réaction. Crédit :Université de Kobe