Les protéines anciennes peuvent offrir des indices sur l'ingénierie des protéines pour résister aux températures élevées requises dans les applications industrielles. Crédit :Institut polytechnique Rensselaer
Les protéines anciennes peuvent offrir des indices sur la façon de concevoir des protéines capables de résister aux températures élevées requises dans les applications industrielles, selon une nouvelle étude publiée dans le Actes de l'Académie nationale des sciences . Les chercheurs ont utilisé des expériences pour examiner les différences critiques entre 15 protéines de la famille des thiorédoxines, y compris sept séquences de protéines éteintes qui remontent à plus de 4 milliards d'années et ont été ressuscitées à l'aide de reconstructions de séquences ancestrales.
« Dans les applications industrielles, les protéines pourraient faire une partie du travail des produits chimiques avec moins d'énergie et moins de toxicité, mais ils doivent pouvoir résister aux températures plus élevées des procédés industriels, " dit George Makhatadze, professeur Constellation de biocalcul et de bioinformatique et membre du Centre de biotechnologie et d'études interdisciplinaires de l'Institut polytechnique Rensselaer. "Cette recherche suggère que les méthodes de reconstruction ancestrales peuvent être utilisées pour concevoir des protéines qui se déploient plus lentement, offrant une plus grande utilité, à des températures plus élevées."
Les expériences ont montré que la différence de stabilité entre les protéines d'une même famille est principalement causée par des différences d'énergie nécessaire pour déployer les protéines, une conclusion qui confirme une théorie de longue date connue sous le nom de "principe de frustration minimale, " proposé par des physiciens il y a environ 30 ans.
Les protéines sont des chaînes moléculaires dans lesquelles chaque maillon est l'un des 20 acides aminés. Une fois la chaîne assemblée, diverses forces sur sa longueur interagissent, faire tordre et tourner la ficelle, et finalement plier en une forme tridimensionnelle. La protéine ne peut remplir sa fonction que lorsqu'elle est correctement repliée. La plupart des protéines restent repliées dans une plage de température définie, pH, ou conditions de pression, se détériorer lorsqu'il est soumis à des conditions en dehors de ces tolérances.
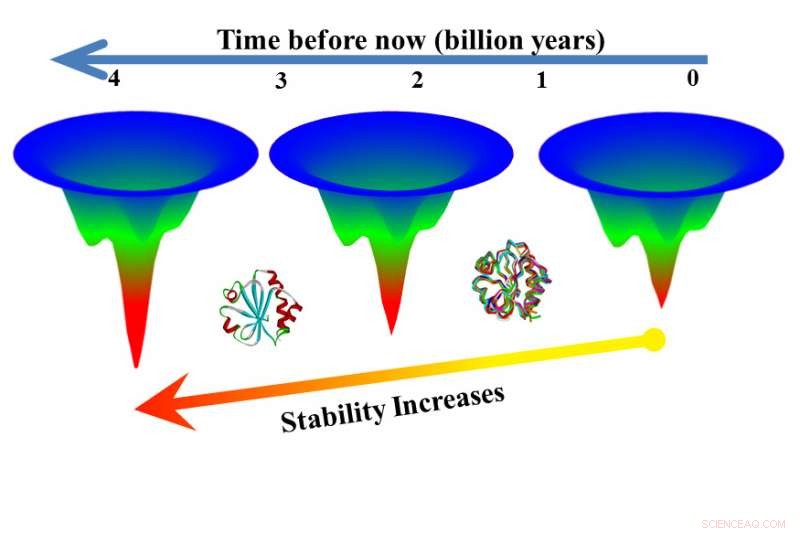
Toutes les règles qui régissent le repliement des protéines ne sont pas connues, et Makhatadze voulait comprendre comment les protéines d'une même famille, avec une structure similaire, sont capables de remplir la même fonction de maintien de la vie dans des environnements thermiques très différents. Thiorédoxines, par exemple, sont présents dans tous les organismes, de ceux qui vivent près des sources hydrothermales bouillantes aux eaux glaciales de l'Arctique.
Une règle connue permet d'expliquer pourquoi il existe un nombre astronomique de séquences possibles pour des protéines avec des centaines voire des milliers de liens, mais seul un petit sous-ensemble de ces séquences possibles se trouve dans la nature. Cette règle, le principe de frustration minimale, postule que la nature ne choisit que les séquences qui se replient le plus efficacement, réduire les interactions indésirables entre les acides aminés et produire plus rapidement, moins frustré, modèles de pliage.
Pour être cohérent avec le principe de frustration minimale, Makhatadze a dit, les protéines ayant une structure similaire mais une stabilité thermodynamique différente devraient se replier le long du même schéma efficace, mais ceux qui ont une plus grande capacité à tolérer la chaleur devraient prendre plus de temps à se développer. Expériences, entrepris d'abord avec huit thiorédoxines modernes, prouvé l'hypothèse correcte.
"Nous avons testé les taux de repliement parmi les thiorédoxines, une famille de protéines qui remplissent la même fonction mais - parce qu'elles fonctionnent dans des conditions thermiques différentes - doivent être différentes en termes de thermodynamique, " dit Makhatadze. " Et ce que nous avons observé, c'est que pour ces protéines, ils se replient en effet avec le même taux, mais ils se déroulent à un rythme différent, c'est ce que nous avions prédit."
A l'étape suivante, les chercheurs ont testé des versions éteintes de thiorédoxines obtenues à l'aide d'une technique appelée reconstruction de séquence ancestrale. Les versions éteintes se sont déroulées plus lentement que les versions modernes, dans certains cas pliage 3, 000 fois plus lentement qu'un homologue moderne.
"Ici, nous avons deux versions d'une protéine de la même famille et une dépliée en sept secondes, l'autre dans six heures, " a déclaré Makhatadze. " Cela signifie que vous pouvez obtenir une fonction utile de la protéine pendant six heures au lieu de sept secondes. Cela montre que la reconstruction de séquences ancestrales peut être une voie vers des protéines plus stables à haute température."
La découverte est étayée par des recherches et des données géochimiques précédemment publiées qui indiquent que la Terre et ses océans étaient plus chauds dans un passé ancien.
"Des recherches antérieures confirment la découverte que les protéines plus anciennes sont plus stables, mais cette nouvelle recherche montre que ces anciennes protéines sont plus stables car elles se déploient plus lentement, " dit Makhatadze.
« La preuve du principe de frustration minimale dans l'évolution des paysages de repliement des protéines » peut être trouvée en utilisant l'identifiant d'objet numérique DOI :10.1073/pnas.1613892114. La recherche a été soutenue par la National Science Foundation. Makhatadze a été rejoint dans la recherche par Fanco Tzul, un chercheur associé postdoctoral, et l'étudiant diplômé Daniel Vasilchuk.
La recherche de Makhatadze est rendue possible par la vision de The New Polytechnic, un paradigme émergent pour l'enseignement supérieur qui reconnaît que les défis et les opportunités mondiaux sont si grands qu'ils ne peuvent pas être traités de manière adéquate même par la personne la plus talentueuse travaillant seule. Rensselaer sert de carrefour pour la collaboration—travaillant avec des partenaires de toutes les disciplines, secteurs, et les régions géographiques—pour relever des défis mondiaux complexes, en utilisant les outils et technologies les plus avancés, dont beaucoup sont développés à Rensselaer. La recherche à Rensselaer aborde certains des défis technologiques les plus urgents au monde, de la sécurité énergétique et du développement durable à la biotechnologie et à la santé humaine. Le New Polytechnic est transformateur dans l'impact mondial de la recherche, dans sa pédagogie innovante, et dans la vie des étudiants de Rensselaer.