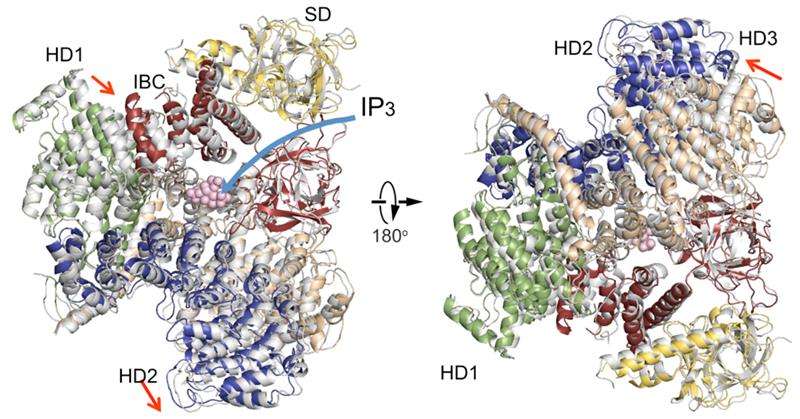
Une comparaison des structures du domaine cytosolique IP3R en l'absence d'IP3 (coloré) avec une en présence d'IP3 (gris). Organisation du domaine. Domaine suppresseur (SD), jaune; Noyau de liaison IP3 (IBC), rouge; domaine hélicoïdal 1 (HD1), vert; domaine hélicoïdal 2 (HD2), bleu; domaine hélicoïdal 3, blé. Crédit :RIKEN
Des chercheurs du RIKEN Brain Science Institute ont déterminé la structure de résolution atomique d'une molécule clé qui traduit les signaux de l'environnement local d'une cellule dans un langage que la cellule peut comprendre et utiliser. La détermination de l'architecture du récepteur tris-phosphate d'inositol (IP3R) a longtemps été considérée comme un objectif majeur de la recherche biomédicale en raison de son rôle stratégique à l'intérieur des cellules en tant que gare moléculaire pour le transfert de signaux contrôlant de nombreuses fonctions cellulaires.
Culminant un effort de près de 10 ans, les chercheurs ont déterminé la structure de résolution atomique d'une molécule clé qui traduit les signaux de l'environnement local d'une cellule dans un langage que la cellule peut comprendre et utiliser. La détermination de l'architecture du récepteur tris-phosphate d'inositol (IP3R) a longtemps été considérée comme un objectif majeur de la recherche biomédicale en raison de son rôle stratégique à l'intérieur des cellules en tant que gare moléculaire pour le transfert de signaux contrôlant de nombreuses fonctions cellulaires. La structure devrait contribuer au développement de meilleures approches thérapeutiques pour de nombreuses maladies. Le travail a été mené par une équipe du RIKEN Brain Science Institute sous la direction du professeur Katsuhiko Mikoshiba, dont le laboratoire a cloné le premier gène IP3R en 1989.
Dans toutes les cellules vivantes, les signaux chimiques sont exploités pour la communication intracellulaire. L'inositol 1, 4, Le 5-trisphosphate (IP3) est l'un de ces signaux qui se lie au récepteur IP3 (IP3R) pour libérer les ions calcium (Ca2+) des réserves intracellulaires de Ca2+ telles que le réticulum endoplasmique. Les réserves de Ca2+ intégrées à IP3R sont distribuées dans divers microdomaines au sein des cellules et jouent un rôle central dans des processus aussi divers que la communication neuronale, différenciation, plasticité, et le métabolisme. Sur les trois gènes identifiés, l'IP3R de type 1 dominant dans le cerveau (IP3R1) est génétiquement responsable de l'ataxie spinocérébelleuse 15/16/29 et du syndrome de Gillespie, et régule les processus d'élimination des déchets cellulaires impliqués dans l'étiologie des maladies neurodégénératives, y compris la maladie d'Alzheimer. Bien que les rôles importants de l'IP3R dans des conditions normales et pathologiques soient bien connus, comprendre comment les signaux IP3 déclenchent l'ouverture du canal Ca2+ était insaisissable.
La nouvelle structure cristalline IP3R1 révèle un riche cosmos de détails à l'échelle atomique sur sa fonction. IP3R1 est une micromachine de 20 nm de diamètre qui contient deux sous-structures fonctionnelles, un site de liaison IP3 et un pore de canal Ca2+. La distance entre le site de liaison IP3 et le pore du canal est de 7 nm, le plus long parmi les canaux ioniques similaires, et la question fondamentale de savoir comment la liaison IP3 ouvre physiquement le canal à longue distance est restée sans réponse au cours des décennies qui ont suivi le clonage du gène. Cristallographie aux rayons X du grand domaine cytosolique d'une IP3R1 de souris en l'absence et en présence d'IP3, à l'usine de faisceaux d'ions RIKEN SPring-8, a mis en évidence un mécanisme à longue portée impliquant un mouvement global dépendant d'IP3 d'une partie du récepteur appelé domaine -hélicoïdal de courbure qui sert de pont entre les domaines cytosolique et canal. La mutagenèse de ce pont a révélé le rôle essentiel d'une structure de feuillet dans le domaine -hélicoïdal qui relaie les signaux IP3 vers le canal, et peut aider à expliquer comment se produit le couplage à longue distance de la liaison IP3 au canal Ca2+.
Les résultats révèlent des similitudes et des différences avec un rapport récemment publié sur l'IP3R utilisant une méthode complètement différente appelée cryomicroscopie électronique. Dans l'étude connexe, un groupe dirigé par Irina Serysheva du Centre des sciences de la santé de l'Université du Texas à Houston a proposé que l'activation du canal par IP3 puisse se produire par liaison directe de l'extrémité C et du domaine de liaison IP3 et par couplage du domaine de liaison IP3 aux sous-unités voisines. Les données actuelles sont en désaccord avec ces conclusions, suggérant plutôt que le site de liaison IP3 à la région du feuillet sous-tend les changements structurels dynamiques par IP3. Une comparaison des deux structures révèle un accord sur une partie immobile du domaine hélicoïdal de courbure et une disposition variable des autres domaines hélicoïdaux. Les auteurs émettent l'hypothèse que la section immobile agirait comme un corps rigide conduisant un couple des sites de liaison IP3 au domaine du canal, alors que les régions flexibles contribueraient aux propriétés dynamiques de la fonction IP3R.
Résoudre le mystère de longue date de la communication à longue portée qui permet à IP3 d'ouvrir le canal aidera à la future conception rationnelle de médicaments ciblant le récepteur qui pourrait permettre une gamme plus diversifiée de voies thérapeutiques. Les résultats pourraient également clarifier les rôles d'IP3R dans la sénescence cellulaire et la suppression tumorale liées à la vulnérabilité sélective des cellules cancéreuses. Étonnamment, l'étude clarifie également un rôle des IP3R dans la fonction d'organismes unicellulaires pathogènes comme Trypanosoma cruzi, le parasite de la maladie de Chagas, et brucei, qui cause la trypanosomose africaine ou la maladie du sommeil. L'équipe a identifié une séquence d'acides aminés dans la notice qui est conservée chez les parasites, suggérant des informations structurelles qui peuvent aider à la découverte de médicaments pour ces conditions dévastatrices.