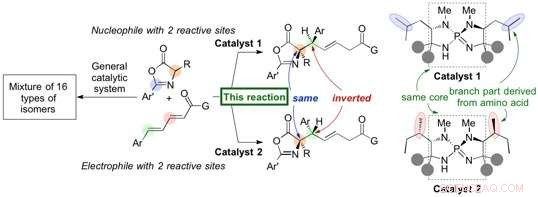
Nouveau système organocatalytique pour générer sélectivement des diastéréoisomères avec un rendement et une sélectivité élevés. Crédit :Université de Nagoya
Des chercheurs de l'Université de Nagoya ont rapporté dans Communication Nature sur le développement d'un catalyseur organique (organocatalyseur) déclenchant une réaction hautement stéréosélective 1, 6-addition d'azlactones (nucléophile) à un composé δ-aryl diényl carbonyle (électrophile) pour générer des dérivés d'acides aminés avec des rendements élevés. Le généré 1, 6-adduit contient deux stéréocentres de carbone, et un léger changement structurel dans l'organocatalyseur conduit à une inversion de la stéréochimie au niveau d'un seul stéréocentre pour former un diastéréoisomère à haute sélectivité. Le groupe a commencé cette recherche en 2012 et a découvert cette inversion de la stéréochimie lors du criblage de divers acides aminés incorporés dans leur catalyseur iminophosphorane unique.
De nombreuses molécules à usage pharmaceutique contiennent des stéréocentres (centres chiraux, lorsqu'un atome a trois atomes ou groupes fonctionnels différents ou plus qui lui sont attachés). Les chercheurs cherchent à développer des réactions stéréosélectives efficaces pour synthétiser un stéréoisomère particulier (isomères qui diffèrent par les orientations tridimensionnelles de leurs atomes dans l'espace). Chaque stéréoisomère a généralement des caractéristiques différentes et un contrôle précis est nécessaire pour obtenir le stéréoisomère souhaité sous une forme pure.
Lors de la connexion d'atomes de carbone auxquels sont attachés trois groupes fonctionnels différents, cela peut entraîner une série de stéréoisomères, dans lequel les groupes fonctionnels sont orientés différemment dans l'espace.
Les énantiomères sont un type de stéréoisomère qui contient un ou plusieurs stéréocentres et sont des images miroir les uns des autres. Jusque là, de nombreuses réactions asymétriques ont été développées pour générer des centres chiraux à haute efficacité. Les diastéréoisomères sont des stéréoisomères d'un composé qui ont différentes configurations à un ou plusieurs stéréocentres et ne sont pas des images miroir les uns des autres.
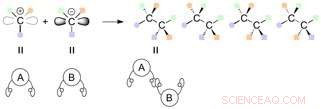
Des réactions entre des carbones contenant trois groupes fonctionnels différents peuvent potentiellement conduire à la génération de 4 produits dont les groupes fonctionnels sont orientés différemment dans l'espace (stéréoisomères). Crédit :Université de Nagoya
Une paire de molécules de carbone avec deux mains différentes peut être connectée dans une variété de combinaisons, et quatre stéréoisomères différents peuvent être synthétisés en théorie. Ces stéréoisomères sont une série d'énantiomères et de diastéréomères dépendant de la relation entre eux (image miroir ou non). Les méthodes conventionnelles pour synthétiser les diastéréoisomères ont nécessité un catalyseur spécifique pour chaque isomère. Dans la plupart des cas, un tout nouveau système catalytique est nécessaire pour obtenir spécifiquement l'un des stéréoisomères.
Lorsque deux molécules à connecter ont chacune quatre mains différentes, la situation se complique et conduit potentiellement à 16 (24) types de stéréoisomères. Puisque la réaction peut maintenant se produire à différentes positions, la génération possible de régioisomères (isomères de position) apparaît également. Afin de fabriquer un stéréoisomère spécifique (régioisomère, énantiomère, ou diastéréoisomère), un système de réaction doit être établi pour que les matières premières réagissent à un site spécifique et dans une orientation spécifique, c'est-à-dire que les molécules soient positionnées pour se tenir la main d'une manière particulière.
Le groupe du professeur Takashi Ooi à l'Institut des biomolécules transformatrices (ITbM) de l'Université de Nagoya a développé des catalyseurs d'iminophosphorane qui peuvent générer des stéréoisomères spécifiques avec un rendement et une sélectivité élevés. De plus, un léger changement dans la structure organocatalyseur conduit à une inversion précise d'un seul stéréocentre pour générer un diastéréoisomère, permettant l'accès à un diastéréoisomère particulier d'intérêt sous une forme pure.
"J'étais vraiment excité au moment où j'ai vu l'inversion en stéréochimie en changeant l'organocatalyseur, " dit Ken Yoshioka, un étudiant diplômé du groupe de recherche du professeur Ooi. "Initialement, nous essayions d'étendre la portée de notre système catalytique à de nouveaux substrats, donc c'était aussi le moment où j'ai pensé que c'était plus qu'une réaction stéréosélective ordinaire."
Le catalyseur iminophosphorane est dérivé d'acides aminés, et un changement dans la structure des acides aminés peut ajuster les propriétés du catalyseur. Dans ce cas, une légère modification de la position des groupes méthyle sur le catalyseur a conduit au diastéréoisomère du 1, 6-adduit.
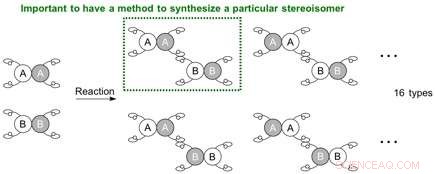
Combinaison possible de stéréoisomères pouvant être générés à partir de la réaction entre des molécules ayant chacune 4 mains différentes. Crédit :Université de Nagoya
« Depuis le début de cette recherche il y a cinq ans, il m'a fallu environ trois ans pour trouver les conditions de réaction optimales après avoir trouvé la réaction d'inversion stéréochimique, " poursuit Yoshioka. " L'un des principaux problèmes était la reproductibilité de cette réaction, car les sélectivités variaient dans chaque réaction. J'avais répété la réaction maintes et maintes fois pour voir ce qui se passait."
"Nous étions vraiment confus par ces résultats variables, et nous avons initialement supposé que la présence d'eau jouait un rôle dans l'état de transition et affectait la sélectivité de cette réaction, " dit Daisuke Uraguchi, professeur agrégé à l'Université de Nagoya. L'élimination complète de l'eau est difficile dans les organocatalyseurs car ils sont capables de former des liaisons hydrogène avec les molécules d'eau.
"Après diverses études d'optimisation, nous avons pu constater que l'abaissement de la température à -30 °C était la clé pour contrôler la sélectivité de ce 1, réaction de 6 additions, " dit Yoshioka. " Cela a pris du temps à comprendre, et ont été soulagés de pouvoir générer des résultats fiables. Nous avons également pu synthétiser de manière stéréospécifique des dérivés de proline diversement fonctionnalisés par d'autres réactions du 1, 6-adduits."
"Nous avons ensuite mené des études expérimentales et informatiques pour trouver une justification à cette inversion stéréochimique unique, " explique Uraguchi. " Les organocatalyseurs qui conduisent à différents diastéréoisomères partagent le même noyau et nous voulions savoir comment la position des groupes méthyle sur le catalyseur affecte la diastéréosélectivité de cette réaction. "
L'analyse par cristallographie aux rayons X et les études DFT (théorie fonctionnelle de la densité) ont révélé que la forme du catalyseur a un rôle majeur dans le positionnement des substrats pour réagir entre eux. "Même si les groupes méthyle semblent être à l'extérieur du catalyseur, ils ont en fait une énorme influence sur le maintien des substrats en place pour réagir sur un visage particulier, " dit Uraguchi. " Nous avons pu montrer qu'une petite différence dans la structure du catalyseur modifie l'état de transition, et conduit à une modification de la diastéréosélectivité.
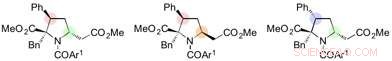
Dérivés de la proline synthétisés à partir du 1, 6-adduits. Crédit :Université de Nagoya
La diastéréodivergence (fabrication de diastéréoisomères à partir d'un ensemble commun de substrats) a été un sujet difficile, mais le groupe a réussi à développer une nouvelle stratégie pour l'inversion de la stéréochimie par leur système de réaction unique.
« J'ai travaillé sur ce projet tout au long de mes études supérieures et je crois que ma persévérance a payé, " dit Yoshioka. " Bien qu'il y ait eu des moments où nous n'étions pas sûrs de ce qui se passait dans la réaction, nous avons vérifié chaque facteur un par un et ce fut un grand sentiment de satisfaction de trouver l'origine de la stéréosélectivité."
"Nous avons été ravis d'accomplir la diastéréodivergence en 1, 6 réactions d'addition avec des niveaux élevés de stéréocontrôle, et envisager que cette stratégie diastéréodivergente fera avancer le domaine de la synthèse asymétrique, " dit Uraguchi et Takashi Ooi, professeur à l'Université de Nagoya, qui a dirigé cette étude. « Nous espérons continuer à fabriquer des catalyseurs uniques qui contribueront à fabriquer des molécules complexes, qui auront des utilisations potentielles dans les industries pharmaceutiques et agrochimiques, " dit Ooi.