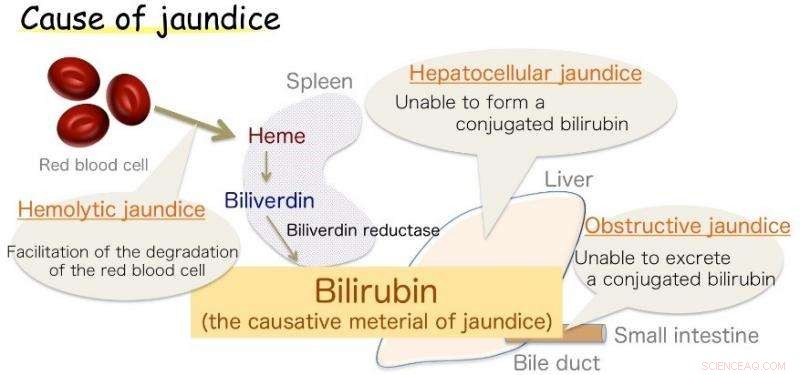
Fig.1 :Cause de la jaunisse. La bilirubine est le matériau responsable de la jaunisse. Crédit :Université d'Osaka
Une équipe de recherche japonaise impliquant l'Université d'Osaka a étudié la biliverdine réductase, l'enzyme produisant la bilirubine – une substance liée à la jaunisse – à partir de la biliverdine (BV). Deux molécules BV ont été trouvées sur le site de réaction enzymatique, dans un arrangement empilé inhabituel. Des expériences de mutation ont confirmé quel acide aminé enzymatique était nécessaire à la production de bilirubine. Dans le mécanisme proposé, cet acide aminé transfère l'hydrogène à une molécule BV, en utilisant l'autre BV comme conduit. Cela facilite la recherche de médicaments anti-jaunisse.
Osaka – Jaunisse, marqué par le jaunissement de la peau, est fréquent chez les nourrissons, mais aussi un symptôme de diverses maladies de l'adulte. Cette décoloration est causée par un excès de bilirubine (BR), la substance qui donne à la bile sa teinte jaune. Cependant, BR est également un antioxydant essentiel, qui, à des niveaux sains, protège les cellules contre les dommages causés par le peroxyde. Sa production dans le corps, bien que, a longtemps été une source d'incertitude.
Maintenant, une collaboration de recherche japonaise impliquant l'Université d'Osaka pense avoir la réponse. BR est déjà connu pour être produit à partir d'un produit chimique apparenté, biliverdine (BV), par l'enzyme biliverdine réductase (BVR). L'enzyme s'enroule autour de BV et transfère deux atomes d'hydrogène - un positif et un négatif - pour produire l'antioxydant jaune. Cependant, les biologistes n'ont pas pu établir quelle partie de l'enzyme était chimiquement impliquée dans le processus (le site actif), ou d'où vient l'hydrogène positif. Les résultats ont été récemment rapportés dans Communication Nature .
"Des études antérieures utilisaient la BVR de rats, et n'a jamais pu cristalliser l'enzyme assez bien pour déterminer comment elle se lie à la VB, ", a déclaré Keiichi Fukuyama, co-auteur de l'étude. "Nous avons réalisé que la même enzyme dans la bactérie Synechocystis avait une forme de pli presque identique, mais était plus facile à examiner par cristallographie aux rayons X."
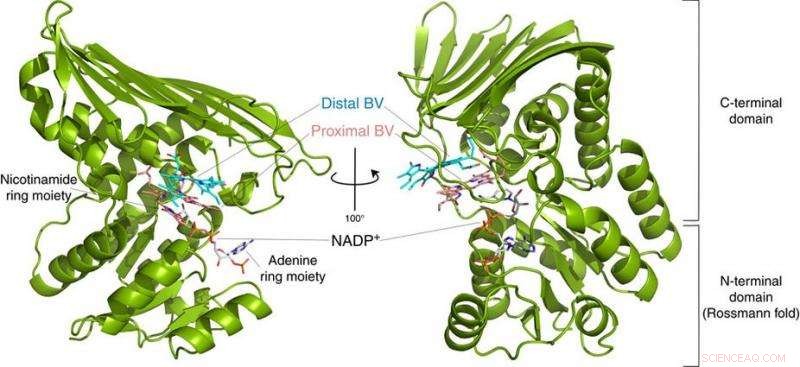
Fig.2 :Structure du BVR. Cette structure a révélé que BVR lie deux substrats de biliverdine (Distal BV et Proximal BV) en même temps. Crédit :Université d'Osaka
A leur grande surprise, les chercheurs ont trouvé deux molécules de BV - l'une empilées l'une sur l'autre - sur le site actif, même si un seul est converti en BR. A partir des données radiographiques, ils ont déduit pourquoi deux étaient nécessaires. Le premier BV, à cause de la direction dans laquelle il fait face pour recevoir l'hydrogène négatif, ne peut pas accepter l'hydrogène positif directement de l'enzyme. Au lieu, le second BV agit comme un conduit d'hydrogène pour permettre le processus, mais n'est pas lui-même converti en BR.
De la structure, les chercheurs ont proposé lequel des 328 acides aminés de l'enzyme fournit réellement l'atome d'hydrogène positif. Puis, ils ont effectué des expériences dans lesquelles les enzymes ont été mutées pour éliminer spécifiquement cet acide aminé, tout en laissant les autres intacts. Les enzymes résultantes, qu'il s'agisse de bactéries, les rats, ou humains, étaient pratiquement incapables de produire BR. D'autres expériences ont confirmé que les enzymes du rat et de l'homme utilisaient également deux molécules BV, tout comme les bactéries.
"Un empilement aussi net de deux molécules de substrat au cours de processus enzymatiques est très rare, " dit Fukuyama. " Une meilleure compréhension de la production de BR n'est pas seulement passionnante pour la biochimie, mais devrait nous aider à développer des médicaments pour les maladies marquées par un ictère sévère dû à un excès de BR, comme l'hépatite."
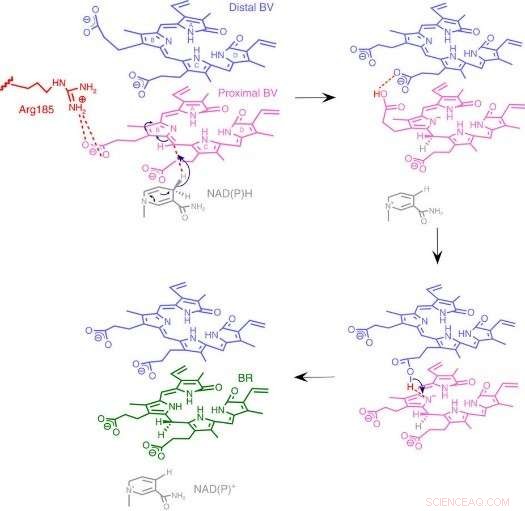
Fig.3 :Mécanisme de la réaction BVR. Nous proposons un mécanisme de réaction unique basé sur une nouvelle structure enzymatique dans laquelle deux substrats empilés se lient à une poche catalytique. Crédit :Université d'Osaka