Une équipe de recherche conjointe dirigée par le Dr Akira Kunitomi, ancien chercheur postdoctoral au CiRA (actuellement chercheur au Gladstone Institute of Cardiovascular Disease) et ID Pharma Co., Ltd., a découvert le rôle crucial de l'histone de liaison spécifique aux ovocytes. , H1FOO, pour améliorer l'efficacité et l'homogénéité de la reprogrammation vers des états pluripotents amorcés et naïfs. L'étude est publiée dans Stem Cell Reports .
Alors que la reprogrammation conventionnelle produit des cellules souches pluripotentes induites par l'homme (iPS) avec des caractéristiques « amorcées », ressemblant à des épiblastes post-implantatoires avec un potentiel limité de transformation en tissus extraembryonnaires, l'état pluripotent « naïf » présente des propriétés plus similaires à celles des cellules épiblastiques préimplantatoires et des cellules iPS de souris. , leur permettant ainsi de se différencier en lignées embryonnaires et extraembryonnaires.
Même si les cellules iPS humaines naïves et amorcées ont permis des avancées biomédicales auparavant inimaginables, l’un des principaux défis concernant les cellules iPS destinées à la recherche fondamentale et à des fins médicales est leur hétérogénéité. Les méthodes de reprogrammation traditionnelles restent un processus stochastique et, par conséquent, de nombreux chercheurs continuent de rechercher des moyens plus efficaces et plus précis pour générer des cellules iPS homogènes.
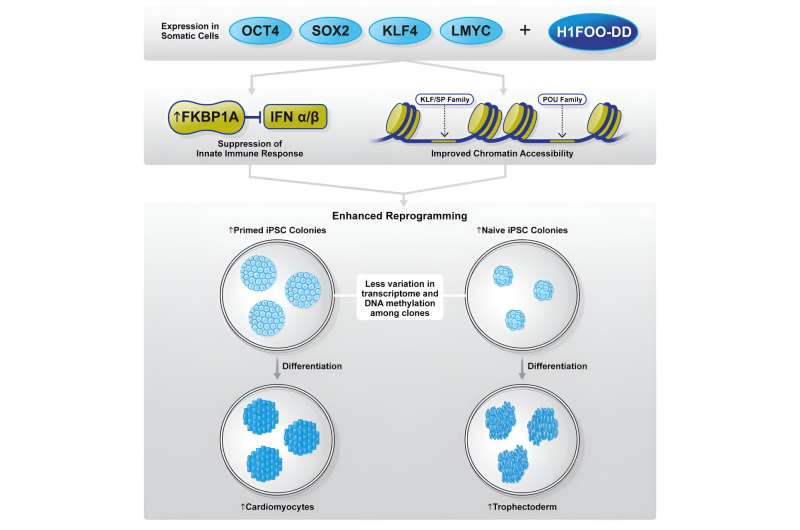
Dans leur étude récente, l'équipe de recherche collaborative a examiné le potentiel de l'histone de liaison H1FOO spécifique à la mère en tant que facteur candidat pour affiner le processus de reprogrammation. Les chercheurs ont conçu H1FOO en attachant un domaine de déstabilisation (DD) afin de pouvoir manipuler chimiquement sa dégradation et réguler soigneusement ses niveaux.
Lorsqu'il est utilisé en combinaison avec les facteurs Yamanaka (OSKL, MYC a été remplacé par LMYC pour éviter la tumorigenèse), ils ont découvert que H1FOO-DD améliorait considérablement l'efficacité de la génération de cellules iPS, quel que soit le système de délivrance de gènes utilisé.
Bien que l'expression génique et les analyses épigénétiques n'aient identifié aucune différence significative entre la reprogrammation utilisant uniquement OSKL ou en combinaison avec H1FOO-DD, elles ont cependant révélé qu'en utilisant H1FOO-DD, les cellules iPS générées indépendamment présentaient un modèle d'expression génique plus similaire. , indiquant ainsi des améliorations en termes d'homogénéité et de reproductibilité.
Notamment, une analyse de gènes à expression hautement variable entre des lignées cellulaires iPS indépendantes a suggéré que H1FOO réduisait cette variabilité de près de moitié. Surtout, bon nombre de ces gènes sont impliqués dans la régulation de l'expression des gènes, démontrant ainsi la capacité de H1FOO-DD à guider le processus de reprogrammation de manière plus stricte.
En outre, les chercheurs ont également observé que les cellules iPS générées par reprogrammation avec H1FOO-DD se différenciaient mieux en endoderme, l'une des trois couches germinales primaires, et en cardiomyocytes (un type de cellule mésodermique).
L'équipe de recherche a poursuivi ses recherches en examinant les mécanismes sous-jacents par lesquels H1FOO-DD améliore la reprogrammation. Par analyse de séquençage d'ARN unicellulaire (scRNA-seq), les chercheurs ont découvert que la reprogrammation avec H1FOO-DD conduisait non seulement à une expression plus précoce et plus élevée de gènes liés à la pluripotence, mais supprimait également l'expression de gènes liés à la réponse immunitaire innée, à l'inflammation et apoptose (mort cellulaire programmée).
En particulier, H1FOO-DD a augmenté la proportion de cellules classées comme reprogrammées avec succès tout en réduisant les sous-populations cellulaires considérées comme ayant subi une reprogrammation incomplète ou infructueuse.
Étant donné le rôle de H1FOO en tant que facteur de remodelage de la chromatine, les chercheurs ont également examiné l'accessibilité aux régions de la chromatine. Conformément aux résultats de l'analyse de l'expression génique, les régions de la chromatine, en particulier les marqueurs de pluripotence proches, se sont ouvertes plus tôt et étaient plus accessibles lorsque H1FOO-DD a été inclus comme facteur de reprogrammation.
Une analyse plus approfondie a démontré que les familles de facteurs de transcription POU et KLF/SP ont été activées plus tôt au cours du processus de reprogrammation par H1FOO-DD. Ces résultats suggèrent que H1FOO-DD aide à coordonner la reprogrammation plus efficacement et plus rapidement pour améliorer la génération de cellules iPS.
Les chercheurs se sont ensuite concentrés sur les effecteurs en aval qui aident à médier les effets positifs de H1FOO-DD sur la génération de cellules iPS en examinant les gènes à expression différentielle dès le début de la reprogrammation. Grâce à cette analyse, ils ont identifié 19 gènes régulés positivement et deux gènes régulés négativement lorsque H1FOO-DD a été inclus comme facteur de reprogrammation.
L’équipe de recherche a examiné ces gènes individuellement pour déterminer s’ils influencent la reprogrammation amorcée et naïve et a découvert que la surexpression de FKBP1A ou APOE améliore la reprogrammation. Puisque APOE avait déjà été signalé comme étant fortement exprimé lors de la reprogrammation, les chercheurs ont concentré leur attention sur FKBP1A dans l'espoir de révéler de nouveaux mécanismes moléculaires à la base d'une reprogrammation réussie.
Ils ont notamment constaté que même si la reprogrammation à l’aide d’OSKL seul augmente l’expression de FKBP1A, l’inclusion de H1FOO-DD l’améliore considérablement. Cette observation a été étayée par le réexamen des données sur l'expression des gènes et l'accessibilité de la chromatine qu'ils avaient déjà collectées.
FKBP1A est une immunophiline impliquée dans l'immunosuppression qui peut interagir avec et inhiber TGFBR1, ce qui, à son tour, favorise la transition mésenchymateuse à épithéliale (MET) et améliore l'efficacité de la reprogrammation.
Les chercheurs ont donc émis l'hypothèse que les deux fonctions de FKBP1A, à savoir la suppression de l'immunité innée et l'inhibition du MET médié par TGFBR1, sont probablement responsables de l'amélioration de l'efficacité de la reprogrammation par H1FOO-DD.
Ils ont notamment découvert que la reprogrammation via une combinaison de surexpression d'OSKL et de FKBP1A entraînait une suppression du TGFBR1, une amélioration du MET, une suppression de la réponse immunitaire innée et une apoptose comparables à celles obtenues lorsque H1FOO-DD était utilisé pour lancer la reprogrammation.
Enfin, comme une analyse antérieure de l’expression génique indiquait qu’en plus d’améliorer la reprogrammation amorcée, H1FOO-DD induisait également l’expression de marqueurs d’état naïf, les chercheurs ont examiné si H1FOO-DD était également capable de favoriser la reprogrammation à l’état naïf. En effet, ils ont observé que l'inclusion de H1FOO-DD améliorait considérablement la génération de cellules iPS naïves.
De plus, analogue à la reprogrammation amorcée, H1FOO-DD a renforcé le processus de reprogrammation en coordonnant une régulation génique et épigénétique plus uniforme dans les cellules. Sur le plan fonctionnel, tel que mesuré par l'activité métabolique et la réactivation du chromosome X, la reprogrammation à l'aide de H1FOO-DD a produit des cellules iPS naïves plus similaires aux cellules souches embryonnaires naïves ou aux blastocystes préimplantatoires que lorsque OSKL était utilisé seul.
En résumé, les efforts combinés de l’équipe de recherche commune ont identifié l’axe H1FOO-FKBP1A comme moyen de reprogrammer les cellules avec une plus grande efficacité et précision. Ces découvertes auront un impact considérable sur la génération de cellules iPS, tant pour la recherche scientifique fondamentale que pour les applications cliniques.
Plus d'informations : Akira Kunitomi et al, H1FOO-DD favorisent l'efficacité et l'uniformité de la reprogrammation vers la pluripotence naïve, Stem Cell Reports (2024). DOI :10.1016/j.stemcr.2024.04.005
Informations sur le journal : Rapports sur les cellules souches
Fourni par l'Université de Kyoto