Une équipe codirigée par des chercheurs de Weill Cornell Medicine et du New York Genome Center a développé une méthode avancée pour révéler comment les mutations génétiques perturbent l'emballage normal de l'ADN. Ces changements structurels, qui modifient les schémas d'activité des gènes dans une cellule, sont appelés changements épigénétiques et peuvent conduire à une malignité.
La nouvelle méthode, décrite dans un article publié dans Nature , offre aux biologistes un outil puissant qui peut être appliqué dans de nombreux domaines d'investigation, de la biologie cellulaire fondamentale à l'étude de l'origine des cancers. Les chercheurs ont démontré la nouvelle méthode en l'utilisant pour éclairer comment une mutation génétique courante exerce ses effets sur deux cancers du sang rares.
"Cette nouvelle technique devrait permettre de vastes explorations futures des liens entre les mutations et les altérations épigénétiques dans le contexte des cancers et des affections associées", a déclaré l'auteur principal de l'étude, le Dr Dan Landau, professeur de médecine à la Division d'hématologie et d'oncologie médicale de Weill. Cornell Medicine et membre principal du corps professoral du New York Genome Center.
L'étude a été codirigée par le Dr Franco Izzo, chercheur postdoctoral au laboratoire Landau pendant l'étude, aujourd'hui professeur adjoint à l'école de médecine Icahn du mont Sinaï.
Cette nouvelle réalisation est la dernière d'une série d'innovations en matière de profilage unicellulaire du groupe de recherche de Landau. De telles méthodes, également appelées méthodes « multi-omiques unicellulaires », permettent aux chercheurs de caractériser les mutations de l'ADN, les modèles d'activité des gènes, les protéines de la surface cellulaire et d'autres couches d'informations, le tout dans une cellule individuelle, en utilisant l'automatisation pour traiter plusieurs milliers de données. cellules à la fois.
En revanche, des méthodes plus anciennes sont utilisées sur des échantillons globaux, qui contiennent généralement des mélanges de différents types de cellules ainsi que des cellules mutées et non mutées, ce qui limite considérablement toute analyse.
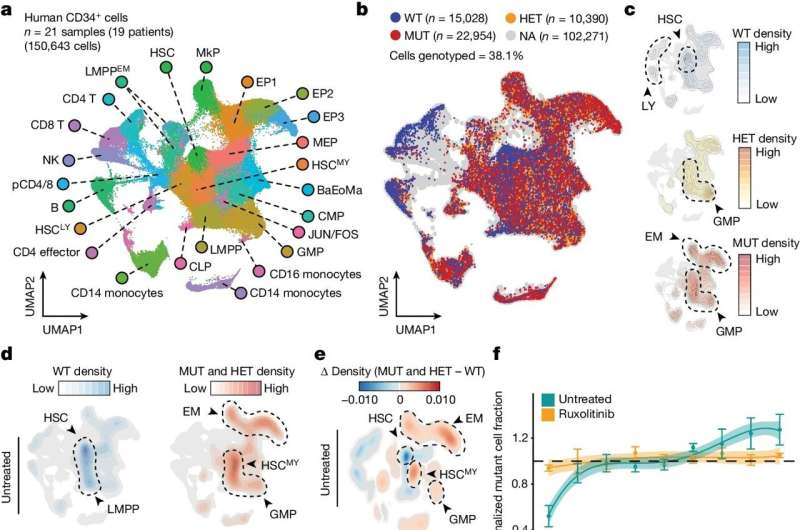
Dans ce cas, l’équipe a développé une méthode unicellulaire plus sensible et plus précise pour détecter les mutations d’intérêt de l’ADN. Ils ont ensuite combiné cela avec une nouvelle technique permettant de cartographier "l'accessibilité de la chromatine" d'une cellule - essentiellement les endroits où l'ADN est relativement ouvert et accessible pour la transcription des gènes - afin d'obtenir une image globale de l'état épigénétique de la cellule.
Les chercheurs ont appelé ces techniques associées « Génotypage de locus ciblés avec accessibilité à la chromatine unicellulaire » ou « GoT-ChA » et ont montré qu'ils pouvaient intégrer GoT-ChA à des méthodes unicellulaires pour profiler d'autres couches d'informations telles que les ARN et les cellules. protéines de surface.
Les scientifiques ont démontré la puissance de leur nouvelle boîte à outils en l’utilisant pour étudier des cellules sanguines prélevées sur des patients atteints de deux cancers du sang rares, la polycythémie essentielle et la myélofibrose. Ces cancers sont généralement provoqués par une mutation spécifique d'un gène appelé JAK2, une mutation qui a été impliquée dans d'autres pathologies et que l'on retrouve également chez de nombreuses personnes apparemment en bonne santé.
Les deux cancers présentent également des perturbations du processus normal de maturation des cellules sanguines, ce qui implique que la mutation JAK2 induit des changements épigénétiques importants, mais les limites des méthodes plus anciennes signifiaient que ces changements épigénétiques et d'autres effets en aval de la mutation n'étaient pas bien compris. Avec GoT-ChA, les chercheurs ont pu cataloguer ces effets de manière très détaillée.
"On pensait que dans la myélofibrose, par exemple, l'inflammation de la moelle osseuse était provoquée par le microenvironnement médullaire, mais nous avons découvert que les changements inflammatoires dans les cellules souches sanguines résultent directement de la mutation JAK2 et dépendent également du type de cellule", a déclaré Landau, qui est également membre du Sandra and Edward Meyer Cancer Center et de l'Englander Institute of Precision Medicine de Weill Cornell Medicine.
Les résultats suggèrent que de nouveaux médicaments inhibiteurs puissants de JAK2, actuellement en développement, pourraient être utiles dans le traitement des patients atteints de myélofibrose, a-t-il déclaré.
Landau a noté que GoT-ChA devrait être généralement utile pour étudier les conditions dans lesquelles les mutations de l'ADN – qui peuvent survenir tout au long de la vie pour diverses raisons – ne sont présentes que dans une minorité de cellules d'un organe et sont donc difficiles, voire impossibles, à étudier avec des méthodes traditionnelles. , techniques pré-unicellulaires.
Les co-premiers auteurs de l'étude, en plus d'Izzo, étaient M.D.-Ph.D. l'étudiant Robert Myers, le boursier postdoctoral Saravanan Ganesan et le doctorant Levan Mekerishvili, tous du laboratoire Landau.
Plus d'informations : Franco Izzo et al, Cartographie des génotypes aux profils d'accessibilité de la chromatine dans des cellules individuelles, Nature (2024). DOI :10.1038/s41586-024-07388-y
Informations sur le journal : Nature
Fourni par l'Université Cornell