Des chercheurs australiens ont mis en lumière les capacités de transformation des assemblages de protéines, avec des résultats qui pourraient révolutionner des domaines allant de la biofabrication au développement de vaccins.
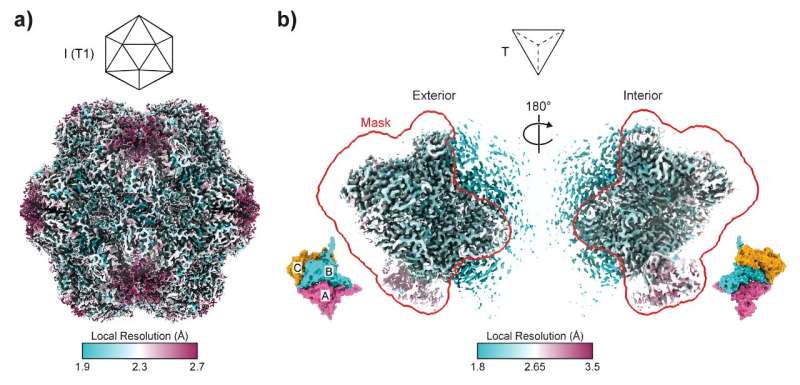
Dirigée par le Dr Taylor Szyszka de l'Université de Sydney et le Dr Yu Heng Lau, du Centre d'excellence ARC en biologie synthétique, recherche publiée aujourd'hui dans les Actes de l'Académie nationale des sciences plonge dans le monde complexe des encapsulines. Ces cages à protéines icosaédriques jouent un rôle crucial dans la fabrication des nanoréacteurs, leurs pores agissant comme des portes vers de minuscules nano-usines.
"En manipulant les pores et en modifiant leur taille et leur charge, nous pouvons mieux contrôler les substrats entrant dans les cages et transformés en produits par les enzymes contenues à l'intérieur", explique le Dr Szyzska.
Cependant, l'exploration de l'équipe a pris une tournure inattendue lorsqu'elle a commencé à effectuer de légères mutations pour en observer les effets.
Ce lancer de dés moléculaire a conduit à la création de structures ressemblant à des tétraèdres, une forme de pyramide très différente des encapsulines sphériques habituelles. En termes de forme d'assemblage, cela revient à changer un dé à 20 faces en un dé à quatre faces. Ces assemblages tétraédriques, comprenant seulement 36 sous-unités protéiques contre 180 habituellement, ouvrent un domaine de possibilités jusqu'alors inexploré en ingénierie des protéines.
"Nous avons découvert que des mutations minimes sont nécessaires pour modifier radicalement la forme de l'assemblage final", explique le Dr Szyszka. "Nous nous attendions à ce que ce soit un processus beaucoup plus compliqué."
Les résultats de l'étude remettent non seulement en question les connaissances existantes sur l'assemblage des protéines, mais offrent également un aperçu de la biologie évolutive. Les encapsulines, bien qu’elles ne soient pas des virus elles-mêmes, partagent des liens évolutifs avec les structures virales. Les chercheurs pensent que la flexibilité observée dans les encapsulines pourrait être attribuée à leur plus petite taille de chargement par rapport aux virus, influençant potentiellement leur capacité à adopter diverses formes.
"Cette découverte suggère qu'il existe d'autres formes que nous pouvons créer, avec de vastes implications pour la bio-ingénierie et la biofabrication", explique le Dr Szyszka.
Grâce à des recherches plus approfondies, l'équipe espère libérer tout le potentiel de ces protéines qui changent de forme, ouvrant la voie à des innovations qui pourraient remodeler les industries et améliorer la santé humaine.
Plus d'informations : Taylor N. Szyszka et al, Une mutation ponctuelle dans une capside de type virus entraîne une réduction de la symétrie pour former des cages tétraédriques, Actes de l'Académie nationale des sciences (2024). DOI : 10.1073/pnas.2321260121
Informations sur le journal : Actes de l'Académie nationale des sciences
Fourni par le Centre d'excellence ARC en biologie synthétique (CoESB)