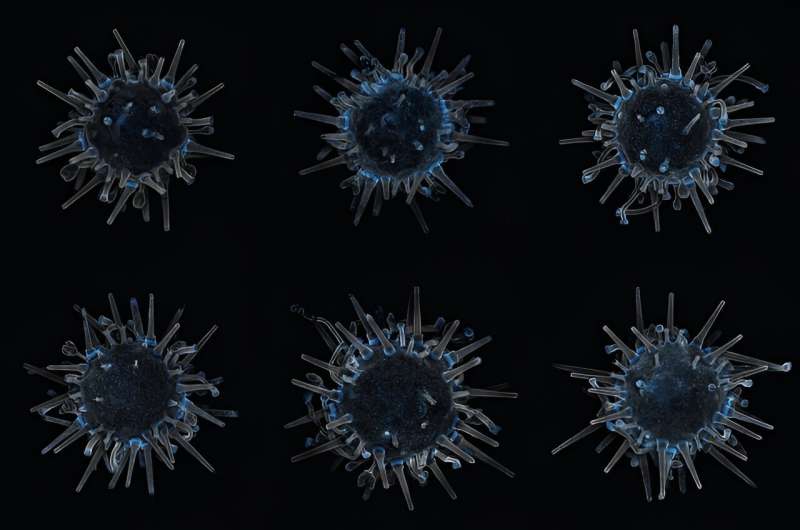
Considérez l'oursin. Plus précisément, l'oursin peint :Lytechinus pictus, une balle de ping-pong épineuse originaire de l'est de l'océan Pacifique.
L'espèce est un cousin plus petit et aux épines plus courtes des oursins violets dévorant les forêts de varech. Ils produisent un nombre massif de spermatozoïdes et d’ovules qui fécondent à l’extérieur de leur corps, ce qui permet aux scientifiques d’observer de près et à grande échelle le processus de création des oursins. Une génération donne naissance à la suivante en quatre à six mois. Ils partagent plus de matériel génétique avec les humains que les mouches des fruits et ne peuvent pas s'envoler :en bref, un animal de laboratoire idéal pour le biologiste du développement.
Les scientifiques utilisent les oursins pour étudier le développement cellulaire depuis environ 150 ans. Malgré le statut de super reproducteurs des oursins, des préoccupations pratiques obligent souvent les scientifiques à concentrer leurs travaux sur des animaux plus facilement accessibles :souris, mouches des fruits, vers.
Les scientifiques travaillant avec des souris, par exemple, peuvent commander en ligne des animaux possédant les propriétés génétiques spécifiques qu'ils espèrent étudier :des animaux transgéniques, dont les gènes ont été artificiellement modifiés pour exprimer ou réprimer certains traits.
Les chercheurs travaillant avec les oursins doivent généralement passer une partie de leur année à les collecter dans l'océan.
"Pouvez-vous imaginer si les chercheurs sur les souris installaient une souricière chaque nuit et que ce qu'ils attrapaient était ce qu'ils étudiaient ?" a déclaré Amro Hamdoun, professeur à la Scripps Institution of Oceanography de l'UC San Diego.
Les invertébrés marins représentent environ 40 % de la diversité biologique du monde animal, mais n'apparaissent que dans une petite fraction d'un pourcentage des études basées sur les animaux. Et si les chercheurs pouvaient accéder aux oursins aussi facilement qu’aux souris ? Et s'il était possible de créer et d'élever des lignées d'oursins transgéniques ?
"Vous savez, pendant la pandémie, tout le monde préparait du levain ? Je ne suis pas doué pour faire du levain", a récemment déclaré Hamdoun dans son bureau du Scripps Hubbs Hall. Il s'est plutôt tourné vers un projet d'un genre différent :un nouvel animal de laboratoire transgénique, "une mouche des fruits de la mer".
En mars, le laboratoire de Hamdoun a publié un article sur le bioRxiv serveur de préimpression démontrant l'insertion réussie d'un morceau d'ADN étranger, en particulier une protéine fluorescente provenant d'une méduse, dans le génome d'un oursin peint qui a transmis le changement à sa progéniture.
Le résultat est le premier oursin transgénique, qui brille comme une ampoule de Noël sous une lumière fluorescente. (Le document a été soumis pour examen par les pairs.)
Ces animaux sont les premiers échinodermes transgéniques, le phylum qui comprend les étoiles de mer, les concombres de mer et d'autres animaux marins. La mission de Hamdoun est de rendre les oursins génétiquement modifiés accessibles aux chercheurs du monde entier, et pas seulement à ceux qui travaillent dans des installations de recherche au bord de l'océan Pacifique.
"Si vous regardez certains des autres organismes modèles, comme la drosophile [mouches des fruits], le poisson zèbre et la souris, il existe des centres de ressources bien établis", a déclaré Elliot Jackson, chercheur postdoctoral à Scripps et auteur principal de l'article. "Si vous voulez une lignée transgénique qui étiquette le système nerveux, vous pourriez probablement l'obtenir. Vous pouvez la commander. Et c'est ce que nous espérons pouvoir faire pour les oursins."
Être capable de modifier génétiquement un animal renforce ce que les scientifiques peuvent en apprendre, avec des implications bien au-delà de n'importe quelle espèce individuelle.
"Cela transformera les oursins en modèle pour comprendre la neurobiologie, la biologie du développement et la toxicologie", a déclaré Christopher Lowe, professeur de biologie à Stanford qui n'a pas participé à la recherche.
La percée du laboratoire, et son objectif de rendre les animaux librement accessibles à d'autres scientifiques, "nous permettront d'explorer comment l'évolution a résolu de nombreux problèmes de la vie vraiment compliqués", a-t-il déclaré.
Les chercheurs ont tendance à étudier les souris, les mouches et autres, non pas parce que la biologie de ces animaux est la mieux adaptée pour répondre à leurs questions, mais parce que « tous les outils nécessaires pour répondre à vos questions ont été développés chez quelques espèces seulement », a déclaré Deirdre Lyons. , professeur agrégé de biologie à Scripps qui a travaillé avec Hamdoun sur les premières recherches liées au projet.
Élargir la gamme d'animaux disponibles pour des travaux de laboratoire sophistiqués, c'est comme ajouter des couleurs à la palette d'un artiste, a déclaré Lyons :« Vous pouvez désormais obtenir la couleur que vous voulez vraiment, qui correspond le mieux à votre vision, plutôt que de vous contenter de quelques modèles. "
Au rez-de-chaussée de l'immeuble de bureaux de Hamdoun se trouve l'aquarium expérimental Hubbs Hall, un espace semblable à un garage rempli de réservoirs remplis d'eau de mer en recirculation et d'un assortiment hétéroclite de vie marine.
Lors d'une récente visite, Hamdoun a fouillé dans un réservoir et a doucement délogeé un gamin peint. Il se déplaçait à une vitesse surprenante sur une paume tendue, comme s'il explorait un terrain extraterrestre.
Le dernier ancêtre commun de L. pictus et d'Homo sapiens vivait il y a au moins 550 millions d'années. Malgré les différents chemins évolutifs que nous avons parcourus depuis, nos génomes révèlent un héritage biologique commun.
Les instructions génétiques qui conduisent à la transformation d’un seul zygote en un corps vivant sont étonnamment similaires chez nos deux espèces. Les systèmes spécialisés se différencient d'un seul œuf fécondé et de la traduction d'un fouillis de protéines en un être vivant singulier :au niveau cellulaire, tout cela se déroule à peu près de la même manière pour les oursins et les humains.
Ces animaux sont "vraiment fondamentaux pour notre compréhension de la vie", a déclaré Hamdoun en remettant l'oursin dans son aquarium. "Et historiquement, très inaccessible génétiquement."
L'aquarium expérimental a été construit dans les années 1970, lorsque la capture de la vie marine était le seul moyen d'acquérir des spécimens de recherche. Quelques étages plus haut dans Hubbs Hall, Hamdoun a ouvert la voie à la pépinière d'oursins, le premier effort à grande échelle visant à élever des générations successives d'animaux dans un laboratoire. À tout moment, l'équipe dispose de 1 000 à 2 000 oursins à différents stades de développement.
Des rangées après rangées de minuscules réservoirs en plastique se trouvaient contre un mur, chacun contenant un oursin juvénile de la taille d'une lentille. Une bande de ruban adhésif sur chaque réservoir indiquait la modification génétique de l'animal et la date de fécondation. Sur certains, un deuxième morceau de ruban adhésif indiquait les animaux dont l'ADN de leurs cellules sexuelles était modifié, ce qui signifie qu'il pouvait être transmis à la progéniture. (Pour cette raison, le laboratoire maintient ses oursins scrupuleusement séparés de la population sauvage.)
"L'une des grandes questions de toute biologie est de comprendre comment la série d'instructions du génome vous donne le phénotype que vous souhaitez étudier", a déclaré Hamdoun - essentiellement, comment la chaîne d'acides aminés qui constitue le code génétique d'un animal donne naissance à aux caractéristiques de la créature vivante et respirante. "L'une des choses fondamentales que vous devez faire est d'être capable de modifier ce génome, puis d'étudier quel en est le résultat."
Il a montré un réservoir contenant un petit oursin dont le code génétique a été extrait de la protéine ABCD1.
ABCD1 agit comme un videur, a expliqué Hamdoun, se garant le long de la membrane cellulaire et éjectant les molécules étrangères. L'action de la protéine peut préserver la cellule des substances nocives, mais peut parfois aller à l'encontre du meilleur intérêt d'un organisme, comme lorsqu'elle empêche la cellule d'absorber un médicament nécessaire.
Les chercheurs utilisant des oursins dans lesquels cette protéine ne fonctionne plus peuvent étudier le mouvement d’une molécule dans un organisme – le DDT, par exemple – et mesurer la quantité de substance qui se retrouve dans la cellule sans l’interférence perturbante de ABCD1. Ils peuvent analyser le rôle important que joue ABCD1 dans la prévention d'une cellule d'absorber un médicament.
Et puis il y a les oursins fluorescents.
"La magie opère dans cette pièce", a déclaré Jackson, entrant dans un bureau étroit avec des microscopes d'une valeur d'un million de dollars à une extrémité et une centrifugeuse à manivelle vieille de plusieurs décennies boulonnée à une table à l'autre.
Il a placé sous un microscope une boîte de Pétri contenant trois oursins transgéniques de la taille d’une gomme à crayon. D'une taille 120 fois supérieure, chacun ressemblait au bal du réveillon du Nouvel An de Times Square prenant vie :une créature lumineuse et ondulante de symétrie radiale pentamère.
La fluorescence n’est pas seulement un truc de fête des échinodermes. L’éclairage des cellules permet aux chercheurs de suivre plus facilement leurs mouvements dans un organisme en développement. Les chercheurs peuvent observer les premières cellules d’une blastula se diviser et se réorganiser en tissu neural ou cardiaque. À terme, les scientifiques pourront désactiver des gènes individuels et voir comment cela affecte le développement. Cela nous aidera à comprendre comment notre propre espèce se développe et pourquoi ce développement ne se déroule pas toujours comme prévu.
Le laboratoire a "fait un excellent travail. Il a été vraiment bien accueilli par la communauté", a déclaré Marko Horb, scientifique principal et directeur de la National Xenopus Resource au Laboratoire de biologie marine de l'Université de Chicago.
Horb dirige le centre national d'échange d'informations sur les espèces génétiquement modifiées de Xenopus, une grenouille griffue utilisée dans la recherche en laboratoire. Le centre développe des lignées de grenouilles transgéniques à usage scientifique et les distribue aux chercheurs.
Hamdoun envisage un centre de ressources similaire pour les gamins de son laboratoire. Ils ont déjà commencé à envoyer de minuscules flacons de sperme d'oursin transgénique aux scientifiques intéressés, qui peuvent élever des oursins sur mesure avec des œufs acquis dans le laboratoire de Hamdoun ou auprès d'une autre source.
Hamdoun se souvient très bien du temps qu'il a passé plus tôt dans sa carrière à essayer de retrouver des extraits aléatoires d'ADN nécessaires à ses recherches, de la déception et de la frustration d'avoir écrit à des professeurs et à d'anciens postdoctorants pour découvrir que le matériel avait été perdu depuis longtemps. Il préfère que les générations futures de scientifiques consacrent leur temps à la découverte.
"La biologie est vraiment intéressante", a-t-il déclaré. "Plus il y aura de gens qui y auront accès, plus nous en apprendrons."
Plus d'informations : Elliot W. Jackson et al, Transgénèse germinale stable utilisant l'élément MinosTc1/marine chez l'oursin, Lytechinus pictus, bioRxiv (2024). DOI :10.1101/2024.03.26.586777
Informations sur le journal : bioRxiv
2024 Los Angeles Times. Distribué par Tribune Content Agency, LLC.