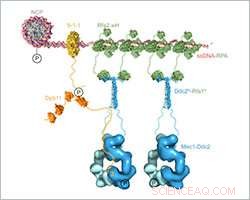
Modèle structurel composite à l'échelle de l'assemblage et de l'activation de Mec1-Ddc2-RPA sur les sites de dommages à l'ADN. Crédit :Institut Friedrich Miescher pour la recherche biomédicale
Ishan Deshpande et ses collègues du groupe de Susan Gasser et du Protein Structure Facility du FMI ont élucidé le mécanisme de la façon dont Mec1-Ddc2, un suppresseur de tumeur impliqué dans la réponse aux dommages à l'ADN s'assemble aux sites de dommages à l'ADN. Ils se concentrent sur l'interaction Ddc2-RPA, qui amène le complexe kinase Mec1-Ddc2 à l'ADN simple brin sur les sites de dommages à l'ADN. Avec leurs données structurelles, les scientifiques du FMI fournissent le chaînon manquant entre deux structures précédemment publiées, leur permettant d'assembler un modèle structurel composite à l'échelle de Mec1-Ddc2 sur ssDNA-RPA sur les sites de dommages à l'ADN.
La kinase ATR suscite l'intérêt depuis plus de 20 ans. Cette kinase est l'une des deux kinases centrales de détection des dommages à l'ADN dans les cellules de mammifères, et c'est aussi un suppresseur de tumeur. Deux composés qui inhibent l'ATR kinase sont en cours d'essais cliniques pour le traitement de la leucémie et des tumeurs solides. Encore, comment cette enzyme est régulée au niveau moléculaire est restée insaisissable.
Ishan Deshpande, un doctorant dans le laboratoire Structure des protéines et le groupe de Susan Gasser au Friedrich Miescher Institute for Biomedical Research (FMI), a maintenant élucidé le mécanisme de la façon dont l'homologue de levure de l'ATR, Mec1, s'assemble sur les sites de dommages à l'ADN pour une activation spécifique au site.
En levure, comme chez l'homme, Mec1 forme un complexe avec une sous-unité régulatrice appelée Ddc2 (ATRIP chez l'homme). En cas de dommages à l'ADN, de grandes étendues d'ADN simple brin (ssDNA) sont exposées, qui sont rapidement recouverts par la protéine de réplication A (RPA). Mec1-Ddc2 reconnaît ces étirements ADNsb-RPA et s'accumule sur ces sites pour initier des mécanismes de réparation.
Deshpande et ses collègues ont maintenant résolu la structure 3-D du N-terminal Ddc2 en association avec une partie de RPA fournissant ainsi des données structurelles sur le lien entre RPA et Mec1, qui était jusqu'ici insaisissable. Nous avons obtenu une structure co-cristalline à haute résolution de l'extrémité N-terminale de Ddc2 avec une sous-unité de RPA, Deshpande a expliqué. Avec ces données, nous avons pu montrer que Ddc2 forme des homodimères et se lie à la RPA par son extrémité N-terminale. De façon intéressante, notre structure Ddc2-RPA est le chaînon manquant entre deux structures précédemment publiées, et cela nous permet d'assembler un modèle structurel composite à l'échelle de Mec1-Ddc2 sur ssDNA-RPA sur les sites de dommages à l'ADN.
L'extrémité N-terminale de Ddc2 facilite non seulement l'interaction de Mec1 avec la RPA, mais sert également d'espaceur pour la kinase Mec1. Deshpande explique :L'extrémité N-terminale Ddc2 allongée permet au grand module de kinase Mec1 de se déplacer sans rencontrer l'ADN endommagé ni la machinerie de réparation travaillant au niveau de la lésion. En outre, l'espaceur Ddc2 peut permettre à Mec1 de phosphoryler plusieurs substrats spatialement distincts tout en restant lié au site des dommages à l'ADN. Vous pouvez considérer le Ddc2 N-terminus comme le cou d'une girafe qui permet à la girafe d'atteindre l'herbe au sol ainsi que les feuilles d'un grand arbre.
Une activité Mec1-Ddc2 appropriée est importante pour toutes sortes de réparations des dommages à l'ADN. Cependant, les données fonctionnelles de Deshpande et ses collègues indiquent que l'extrémité N-terminale de Ddc2 est particulièrement importante pour la survie des cellules après des dommages à l'ADN par la lumière UV. Notre modèle suggère que le simple recrutement de Mec1-Ddc2 au ssDNA peut contribuer à son homodimérisation et donc à l'activation du complexe Mec1-Ddc2, explique Deshpande.
En outre, Susan Gasser souligne "que cela a été une merveilleuse collaboration entre mon laboratoire et la structure de l'IMF, nous permettant de passer de la structure à la fonction."