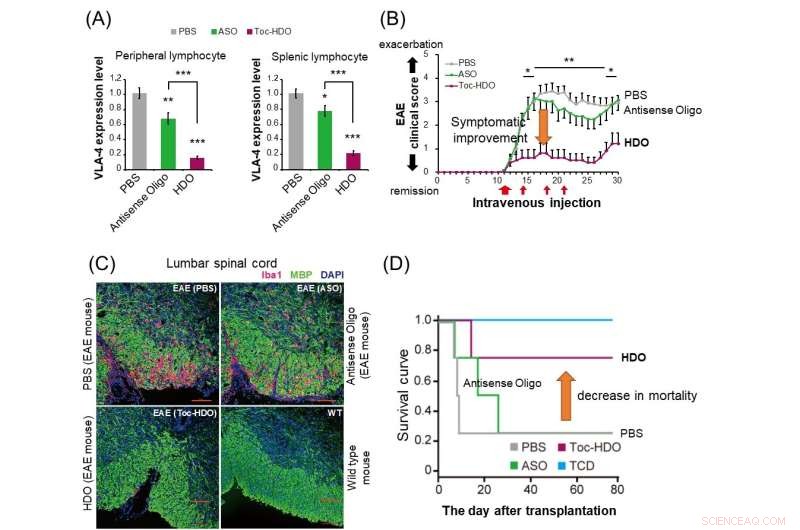
(A) Chez les souris normales, l'administration de HDO (barre rouge) supprime plus radicalement l'expression du gène de l'intégrine α4β1 dans les lymphocytes périphériques et spléniques par rapport à l'oligonucléotide antisens (barre verte). (B) Chez des souris expérimentales d'encéphalomyélite auto-immune (EAE), l'administration de HDO ciblant l'intégrine α4β1 après l'apparition des symptômes a montré une amélioration du score clinique. (C) L'administration de HDO ciblant l'intégrine α4β1 avant l'apparition des souris EAE entraîne une réduction de l'infiltration des cellules inflammatoires positives Iba1 (rouge) et une démyélinisation améliorée (vert) dans la moelle épinière lombaire. (D) Dans le modèle murin de greffe contre -maladie de l'hôte (GVHD), la transplantation de cellules T dérivées de la rate avec des cellules de moelle osseuse après traitement avec HDO ciblant l'intégrine α4β1 a amélioré la courbe de survie. TCD :Cellules de moelle osseuse transplantées sans lymphocytes T dérivés de la rate. Crédit :Département de neurologie et des sciences neurologiques, TMDU
Les lymphocytes T et B, qui font partie d'un groupe de cellules immunitaires communément appelées globules blancs, travaillent ensemble pour éliminer les envahisseurs étrangers dans le corps tels que les virus. Cependant, certaines maladies peuvent survenir lorsque les cellules T et B sont activées à des moments inappropriés, notamment des maladies auto-immunes et divers cancers. Dans un article récent publié dans Nature Communications , une équipe dirigée par des chercheurs de l'Université médicale et dentaire de Tokyo (TMDU) décrivent une technologie appelée oligonucléotide hétéroduplex (HDO) qu'ils ont développée pour délivrer aux lymphocytes et réguler leurs fonctions.
L'expression des gènes est à la base du contrôle de l'activité cellulaire. La maladie peut survenir lorsque certains gènes sont soit désactivés de manière inappropriée, soit exprimés de manière incontrôlable. Par conséquent, les scientifiques ont cherché à développer des méthodes thérapeutiques pour restaurer les niveaux d'expression des gènes à leur état sain, idéalement uniquement dans les cellules anormales. L'une de ces modalités consiste à délivrer des molécules d'ADN ou d'ARN spécialement conçues pour localiser les messages géniques mal exprimés et diriger la cellule pour les ramener à des niveaux normaux. Cependant, la partie la plus difficile consiste à s'assurer que les molécules thérapeutiques peuvent atteindre efficacement leur destination appropriée sans être dégradées par la cellule.
"Notre équipe a conçu une molécule hybride ADN/ARN appelée HDO", explique l'auteur principal de l'étude, Masaki Ohyagi. "La séquence spécifique de l'HDO peut être modifiée pour cibler un gène d'intérêt particulier, tandis que son squelette le rend stable dans les cellules."
Un élément clé de la conception HDO de l'équipe est l'ajout d'une molécule appelée α-tocophérol, qui est cruciale pour sa bonne administration. Parce que l'α-tocophérol est essentiel pour des réponses immunitaires lymphocytaires appropriées, l'ajout de cela permet à l'HDO d'être délivré dans le sang périphérique et dirigé vers les lymphocytes. L'équipe a conçu des HDO pour plusieurs gènes de souris, puis les a injectés par voie intraveineuse à des souris de laboratoire.
"Nous avons constaté que notre technologie HDO était capable de réduire spécifiquement au silence ces gènes dans les lymphocytes de souris de manière plus robuste et stable, et également avec moins de toxicité, que les autres versions précédentes de cette méthode", déclare Takanori Yokota, auteur principal de l'article. "Nos études ont également montré que les HDO pénètrent dans ces cellules par un processus appelé endocytose."
Après avoir découvert que leur technologie était efficace pour le silençage génique, l'équipe TMDU a cherché à savoir si elle pouvait être utile comme traitement de la maladie. Ils ont conçu un HDO ciblant un gène appelé Itga4, qui est au cœur de la pathogenèse de l'encéphalomyélite auto-immune expérimentale (EAE), un modèle murin de la sclérose en plaques (SEP).
"L'injection intraveineuse à ces souris d'un HDO ciblant Itga4 a retardé l'apparition et amélioré les symptômes de l'EAE et réduit à la fois l'infiltration des cellules inflammatoires et la démyélinisation de la moelle épinière", explique Ohyagi.
Ce travail démontre les puissants effets de silençage génique de la technologie HDO, ainsi que ses capacités de livraison supérieures par rapport à d'autres méthodes similaires. Plus important encore, l'HDO spécifique d'Itga4 a pu améliorer les résultats dans un modèle de souris SEP, ce qui suggère qu'il pourrait être utile en tant que nouveau traitement thérapeutique pouvant être développé pour les maladies à médiation immunitaire humaine.