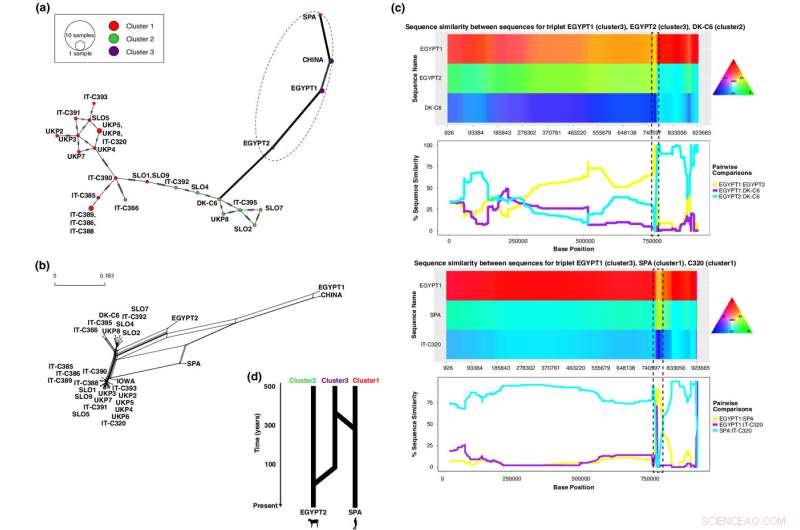
L'analyse de recombinaison du chromosome 1 identifie deux séquences hybrides, Spa1 (un isolat humain du groupe 1) et Egypt 2 (un isolat de veau du groupe 3). ( a ) Réseau montrant que les haplotypes des isolats hybrides Spa1 et Egypt2 divergent du reste des isolats et sont étroitement associés à leurs séquences parentales mineures (isolats du groupe 3). ( b ) Réseau phylogénétique montrant des boucles entre des isolats hybrides, représentant une recombinaison potentielle. ( c ) Parcelles de similarité de séquence obtenues avec HybridCheck pour différents triplets d'isolats impliqués dans un événement de recombinaison (hybride, parent majeur, parent mineur). La similarité de séquence est montrée le long des positions chromosomiques (axe des x) par une carte des couleurs dans laquelle les régions avec le même polymorphisme partagent des couleurs (en haut) et par des graphiques linéaires indiquant le pourcentage de similarité sur l'axe des y (en bas). Les graphiques des régions recombinantes qui présentent une forte similarité entre les isolats hybrides et leurs séquences parentales mineures au niveau des régions recombinantes sont entourés de cases en pointillés. ( d ) Représentation schématique des événements de recombinaison dans les isolats hybrides, qui montre qu'Egypt2 et Spa1 ont tous deux reçu une variation génétique d'un groupe 3, environ 49 (21–96; IC 95%) et 289 (204–395; IC 95%) ans il y a, respectivement. Crédit :Écologie moléculaire (2022). DOI :10.1111/mec.16556
Les parasites qui causent une diarrhée sévère sont susceptibles de devenir plus virulents en raison de la vitesse à laquelle ils échangent leur ADN et évoluent, selon de nouvelles recherches de l'Université d'East Anglia.
Les chercheurs ont étudié les génomes de Cryptosporidium parvum, un parasite zoonotique qui provoque une diarrhée sévère chez les humains et les animaux.
Ils ont découvert que différentes lignées de ces parasites échangent de plus en plus leur ADN, ce qui a aidé le parasite à évoluer plus rapidement, ce qui a potentiellement pour résultat des souches plus virulentes et mieux adaptées.
La nouvelle étude montre que les lignées de Cryptosporidium parvum ont échangé plus d'ADN au cours des 200 dernières années qu'auparavant.
Et ils attribuent cela à la mondialisation et à notre contact de plus en plus étroit avec les animaux, ce qui augmente le taux d'événements de débordement.
L'un des principaux chercheurs, le professeur Cock Van Oosterhout, de l'École des sciences de l'environnement de l'UEA, a déclaré :"Cryptosporidium est un genre important de parasites zoonotiques, et c'est l'un des nombreux micro-organismes qui causent des maladies diarrhéiques chez les humains et certains animaux d'élevage. Dans l'homme, elle est responsable d'environ 57 000 décès chaque année, dont 80 % chez les enfants de moins de cinq ans.
"La grande majorité d'entre eux se trouvent dans des pays à faible revenu, mais des épidémies se produisent également au Royaume-Uni et ailleurs en Europe. Il n'existe aucun médicament ou vaccin efficace disponible, il est donc essentiel de comprendre la transmission et l'évolution de ce parasite.
"Nous savons qu'il existe plusieurs lignées du parasite Cryptosporidium parvum, mais nous voulions en savoir plus sur leur évolution, et en particulier, pourquoi cette espèce peut devenir plus virulente qu'elle ne l'était par le passé."
L'équipe, dirigée par l'UEA en collaboration avec des scientifiques italiens et australiens, a utilisé l'analyse de la séquence du génome entier pour en savoir plus sur ces échanges génétiques.
Ils ont comparé 32 séquences du génome entier de souches humaines et animales collectées en Europe, aux États-Unis, en Égypte et en Chine.
Le professeur Van Oosterhout a déclaré :"Nous avons constaté que différentes lignées de ces parasites échangent de plus en plus leur ADN. Au cours des 200 dernières années, environ 22 % du génome de ces parasites ont été échangés.
"C'est beaucoup plus que l'ADN qu'ils ont échangé tout le temps auparavant. Les gènes impliqués dans la virulence semblent être particulièrement affectés par de tels échanges génétiques. Le génome des parasites qui infectent les humains possède de l'ADN de parasites que l'on trouve normalement dans vaches et agneau.
"Nous pensons que ces échanges génétiques aident le parasite à évoluer plus rapidement, et que cela peut se traduire par des parasites humains plus virulents et mieux adaptés. C'est vraiment important car, comme le COVID-19 nous l'a montré, les parasites humains peuvent évoluer rapidement.
"Nous émettons l'hypothèse que le taux d'évolution est encore accéléré car le parasite peut évoluer dans plusieurs espèces hôtes. Cela signifie que de nouvelles adaptations qui ont évolué chez les parasites qui infectent une espèce hôte peuvent maintenant être utilisées par des parasites qui infectent une autre espèce d'hôtes.
"La connectivité accrue dans notre monde globalisé et les contacts étroits entre les humains et les animaux domestiques augmentent le taux d'événements de débordement et de débordement.
"En utilisant l'analyse de la séquence du génome entier, nous pouvons désormais étudier ces échanges génétiques et identifier quand et où ils ont lieu. Cela nous aidera à mieux contrôler ces maladies infectieuses émergentes de parasites et d'agents pathogènes zoonotiques", a-t-il ajouté.
« Les échanges génétiques récents et les mélanges façonnent le génome et la structure de la population d'un parasite zoonotique » est publié dans la revue Molecular Ecology .