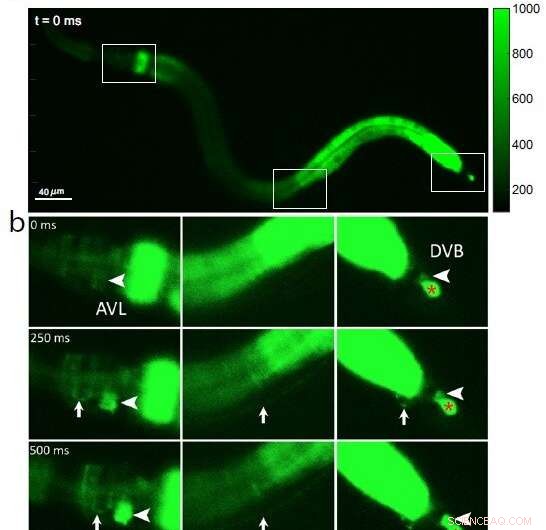
Fig 1 :Images de fluorescence calcique d'un ver C. elegans entier, montrant (a) trois sections encadrées d'intérêt de la tête à la queue (de gauche à droite) au temps 0 avant l'activation des cellules nerveuses; (b) une vague initiale de calcium dans l'intestin est suivie par l'activation du corps des cellules nerveuses AVL dans la tête (grande pointe de flèche, panneau de gauche), fibre nerveuse AVL (petite flèche, panneaux de gauche et du milieu), jonction nerf-muscle préanale (petit flèche, panneau de droite) et corps de cellule nerveuse DVB dans la queue (grande pointe de flèche, panneau de droite). En tant que référence de contrôle négatif, le rouge * dans le panneau de droite montre une cellule non affectée qui n'est pas pertinente pour le cycle de défécation. Crédit :Jiang, J. et al, Nature Communications (2022). DOI :10.1038/s41467-022-30452-y
Une équipe co-dirigée par un neuroscientifique de la City University of Hong Kong (CityU) a identifié un mécanisme clé d'une horloge biologique qui garantit que les ascaris restent réguliers en déféquant à intervalles réguliers.
L'étape de défécation est sous le contrôle chronométré d'une cellule nerveuse située dans la tête du ver. Cette cellule déclenche une impulsion nerveuse, ou rafale de décharge électrique, toutes les 45 secondes environ. Chaque impulsion est immédiatement transmise le long du ver à travers une fibre nerveuse qui entre en contact avec une cellule nerveuse de la queue. Cette cellule déclenche alors une impulsion avec l'impulsion quasi synchronisée de la cellule nerveuse de la tête qui stimule les muscles de l'intestin inférieur pour expulser les matières fécales.
"Le ver rond d'un millimètre de long Caenorhabditis elegans, ou C. elegans, est utilisé comme organisme modèle par les scientifiques du monde entier. Lorsque les vers de type sauvage sont en présence de beaucoup de nourriture, ils mangent constamment sans s'arrêter mais caca toutes les 45 secondes avec une précision presque horloge. Pourquoi et comment les vers font cela a incité les chercheurs à étudier ses mécanismes sous-jacents ", explique le co-chef de l'équipe, le Dr Liu Qiang, professeur adjoint au département de neurosciences de CityU. "Nos découvertes résolvent ce mystère vieux de 30 ans et approfondissent notre compréhension de la génération de comportements rythmiques, ainsi que des liens entre le système nerveux et la physiologie d'un animal."
La recherche a été supervisée conjointement par le Dr Liu Qiang de CityU et le Dr Louis Tao de l'Université de Pékin. Les résultats ont été publiés le 19 mai 2022 dans Nature Communications , sous le titre "Les motoneurones entériques de C. elegans déclenchent des potentiels d'action synchronisés sous-jacents au programme moteur de défécation."
Circuit intestin-cerveau
C. elegans est bien étudié dans les neurosciences et la recherche sur le cerveau, et les 302 cellules de son système nerveux ont été identifiées, nommées et cartographiées physiquement avec toutes leurs connexions nerveuses. Les deux cellules nerveuses importantes impliquées dans la régulation des selles sont AVL dans la tête et DVB dans la queue.
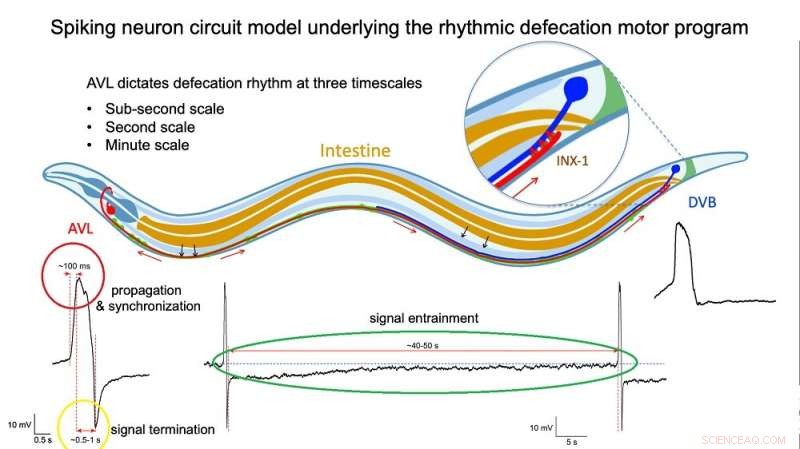
Fig 2 :Illustration du modèle de circuit de neurones à pointes sous-jacent au comportement de défécation rythmique. Crédit :Dr Liu Qiang/Université de la ville de Hong Kong
"Les chercheurs savaient que l'intestin de C. elegans génère une augmentation périodique du calcium appelée ondes calciques dans les cellules de l'épithélium, ce qui provoque la libération de neuropeptides intestinaux qui stimulent les cellules nerveuses AVL et DVB, conduisant à la défécation. Cependant, les mécanismes sous-jacents de communication entre l'intestin et le cerveau étaient inconnus. Comment les deux neurones entériques, l'un dans la tête du ver, l'autre dans la queue, communiquent-ils sur une si longue distance tout en traitant le signal de synchronisation reçu de l'intestin avec une robustesse et une précision remarquables ? » dit le Dr Liu. "Pour la première fois, nous avons montré que les cellules nerveuses AVL et DVB produisent des impulsions à pointes tout ou rien, ou potentiels d'action, et cette signalisation numérique permet à AVL dans la tête d'effectuer une communication longue distance instantanée avec DVB dans la queue pour réglementer l'expulsion des matières fécales."
Parce que les ions calcium se précipitent dans la cellule lors de chaque impulsion nerveuse, les chercheurs ont examiné la signalisation AVL-DVB en utilisant un microscope spécial pour filmer des vers qui avaient été programmés pour briller en vert fluorescent en présence de calcium. Ils ont d'abord observé une vague générale de calcium se déplacer dans l'intestin. Après environ 3 secondes, ils ont détecté des pics de calcium presque simultanés dans AVL et DVB qui ont duré une demi-seconde et se sont reproduits environ une fois toutes les 45 secondes (voir Figure 1).
Les pics de calcium dans AVL et DVB coïncidaient avec des mouvements musculaires de la tête à la queue qui se produisaient presque en même temps que l'expulsion des matières fécales. À partir de ces résultats, les chercheurs concluent que bien que l'intestin lui-même soit le stimulateur général de la défécation, les impulsions AVL et DVB synchronisées contrôlent le moment précis et la coordination des mouvements du corps et de l'intestin de la tête à la queue nécessaires à l'étape d'expulsion.
Potentiel d'action multitâche
Des mesures directes de la tension à travers la membrane de cellules AVL et DVB isolées ont confirmé les profils dopés de leurs potentiels d'action. Un examen plus approfondi a révélé que l'impulsion AVL est un potentiel d'action inhabituel composé de deux pointes rapprochées. Le premier pic agit comme un signal positif et rapide (montée du signal en environ 100 millisecondes, cercle rouge sur la figure 2) qui se propage rapidement au DVB (en millisecondes) et active la séquence de mouvements musculaires conduisant à une selle. Le deuxième pic agit comme un signal négatif et plus lent (en secondes, cercle jaune sur la figure 2) qui éteint la séquence pour inhiber d'autres selles et ainsi empêcher une excrétion excessive. De plus, chaque impulsion AVL est également suivie d'une phase de sous-dépassement négatif de longue durée (en dizaines de secondes, cercle vert sur la figure 2) qui inhibe les impulsions de ratés DVB lorsqu'il n'est pas censé le faire.
"La cellule nerveuse AVL dans la tête joue le rôle le plus crucial dans la régulation du rythme de défécation à plusieurs échelles de temps", explique le Dr Liu. "Il relaie non seulement mais module également le signal du stimulateur cardiaque provenant de l'intestin en réinitialisant le système lors de chaque cycle de défécation et en empêchant les ratés nerveux entre les cycles, de sorte que l'horloge biologique reste robuste et précise."
Cette étude ouvre la voie à de nouvelles recherches sur la communication intestin-cerveau et d'autres systèmes d'horloge biologique sous-jacents aux comportements animaux répétitifs. "Je n'ai aucun doute que les principes fondamentaux du fonctionnement cérébral tirés de l'étude des vers seront utilisés comme tremplin pour mieux comprendre les cerveaux plus complexes comme le nôtre", ajoute le Dr Liu.