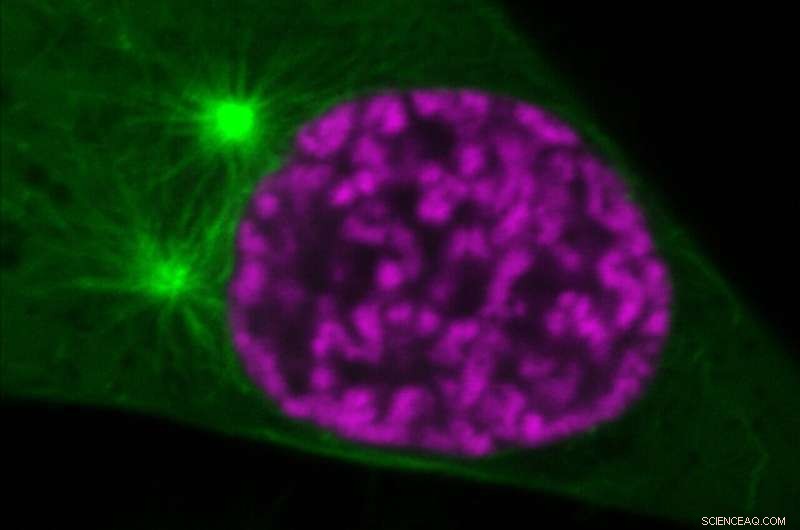
Organisation des chromosomes mitotiques (magenta) et des microtubules du fuseau (vert) à une phase précoce de la division cellulaire. Peu de temps après ce qui est montré sur l'image, les microtubules envahiront l'espace nucléaire. Cependant, la compaction de la chromatine régulée par l'acétylation des histones empêchera la perforation des chromosomes par les microtubules. Crédit :©Gerlich/IMBA
Des chercheurs du groupe Gerlich de l'IMBA - Institut de biotechnologie moléculaire de l'Académie autrichienne des sciences - ont découvert un mécanisme moléculaire qui confère des propriétés physiques particulières aux chromosomes lors de la division des cellules humaines pour permettre leur transport fidèle vers la descendance. L'équipe a montré comment une modification chimique établit une limite de surface nette sur les chromosomes, leur permettant ainsi de résister à la perforation par les microtubules de l'appareil à fuseau. Les résultats sont publiés dans la revue Nature .
Lorsque les cellules se divisent, elles doivent transporter exactement une copie du génome vers chacune des deux cellules filles. La ségrégation fidèle du génome nécessite le conditionnement de molécules d'ADN chromosomique extrêmement longues dans des corps discrets afin qu'elles puissent être efficacement déplacées par le fuseau mitotique, un système de filaments composé de milliers de microtubules. Les nouvelles découvertes du groupe de recherche Gerlich de l'IMBA - Institut de biotechnologie moléculaire de l'Académie autrichienne des sciences - mettent en lumière la façon dont les chromosomes mitotiques résistent aux forces de poussée et de traction constantes générées par les microtubules. "Au milieu de ce système complexe, les propriétés physiques distinctes sont conférées aux chromosomes en modifiant les niveaux d'acétylation des histones, une modification chimique au sein de la fibre de chromatine", explique Daniel Gerlich, responsable du groupe IMBA.
Des travaux antérieurs avaient montré que, dans les cellules en division, les fibres de chromatine sont pliées en boucles par un grand complexe protéique appelé condensine. Cependant, le rôle de la condensine à lui seul ne pouvait pas expliquer pourquoi les chromosomes apparaissent comme des corps denses avec une surface pointue plutôt qu'une structure lâche ressemblant à un goupillon. Certaines études avaient suggéré un rôle de l'acétylation des histones dans la régulation du niveau de compactage au cours de la division cellulaire, mais l'interaction de l'acétylation des histones avec la condensine et sa pertinence fonctionnelle restaient incertaines. "Grâce à nos travaux, nous sommes maintenant en mesure de démêler conceptuellement les deux mécanismes", déclare Gerlich.
L'équipe a fait varier les niveaux de condensine et d'acétylation des histones pour étudier leurs effets précis. L'élimination de la condensine a perturbé la forme allongée des chromosomes dans les cellules en division et réduit leur résistance aux forces de traction, mais n'a pas affecté leur niveau de compaction. La combinaison de l'épuisement de la condensine avec un traitement qui augmente les niveaux d'acétylation des histones a provoqué une décompression massive de la chromatine dans les cellules en division et une perforation des chromosomes par des microtubules.
Les chercheurs ont émis l'hypothèse que la chromatine est organisée comme un gel gonflé pendant la majeure partie du cycle cellulaire (lorsqu'elle est relativement fortement acétylée) et que ce gel se compacte en une forme insoluble lors de la division cellulaire lorsque les niveaux d'acétylation diminuent globalement. Ils ont ensuite développé un test pour sonder la solubilité de la chromatine en fragmentant les chromosomes mitotiques en petits morceaux. Les fragments de chromosomes mitotiques formaient des gouttelettes de chromatine liquide, mais lorsque le niveau d'acétylation augmentait, les fragments de chromatine se dissolvaient dans le cytoplasme. Ces observations soutiennent un modèle dans lequel une réduction globale de l'acétylation de la chromatine pendant la mitose établit un gel de chromatine non miscible avec une limite de phase nette, fournissant une base physique pour la résistance à la perforation des microtubules.
Avec d'autres expériences impliquant de la chromatine pure reconstituée in vitro et en sondant l'accès à la chromatine par diverses macromolécules solubles, l'équipe a découvert que la chromatine non miscible forme une structure dense en charge négative qui exclut les macromolécules et les microtubules chargés négativement. "Notre étude montre comment la boucle d'ADN par le complexe de condensine coopère avec un processus de séparation de phase de la chromatine pour construire des chromosomes mitotiques qui résistent à la fois aux forces de traction et de poussée exercées par le fuseau. La désacétylation des histones lors de la division cellulaire confère donc des propriétés physiques uniques aux chromosomes qui sont nécessaires à leur ségrégation fidèle », conclut Daniel Gerlich.