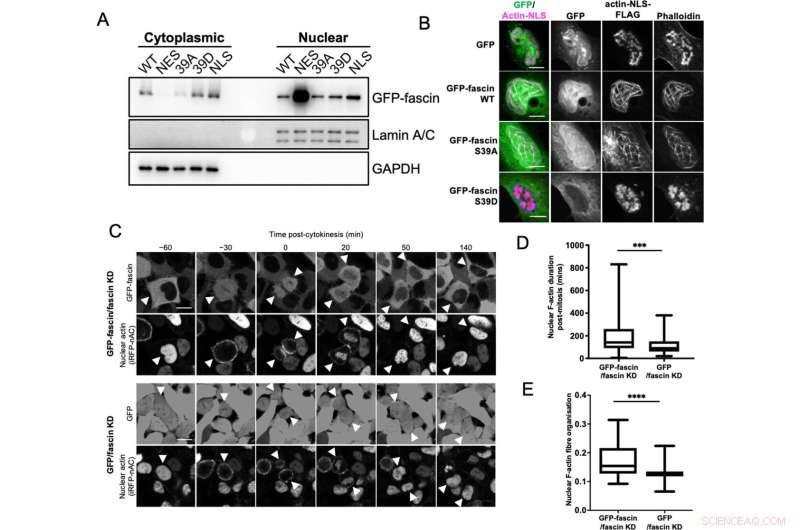
La fascine nucléaire contribue au regroupement de la F-actine. (A) Western blot représentatif de cellules HeLa renversées par la fascine (KD) exprimant des constructions GFP-fascine spécifiées soumises à un fractionnement biochimique. Compartiments nucléaires et cytoplasmiques sondés pour GFP-fascine (80 kDa), Lamin A/C (69/62 kda) et GAPDH (36 kDa). Représentant de trois expériences indépendantes. (B) Images confocales représentatives des noyaux de cellules fascin KD HeLa co-exprimant des constructions GFP-fascine spécifiées (vert) et la construction actine-NLS-FLAG, fixées et colorées pour FLAG (magenta) et F-actine (phalloïdine). Les barres d'échelle sont de 10 µm. (C) Images fixes représentatives de films confocaux time-lapse de cellules fascin KD HeLa co-exprimant la GFP ou la GFP-fascine (panneaux du haut) et la sonde nucléaire F-actine iRFP-nAC (panneaux du bas) avant et après la cytokinèse. Les pointes de flèche pointent vers des cellules filles ou en division. Les barres d'échelle sont de 10 µm. (D) Quantification de la durée des filaments nucléaires de F-actine dans les cellules comme dans (C). (E) Organisation de la F-actine nucléaire dans des cellules synchronisées, 10 heures après la libération. Pour (D) et (E), N =89–100 cellules/condition, regroupées à partir de trois expériences indépendantes. Les graphiques montrent le min/max et la moyenne de l'ensemble de données. ***=p <0,001, ****=p <0,0001. Crédit :eLife (2022). DOI :10.7554/eLife.79283
Des chercheurs ont montré qu'une protéine appelée fascine agit dans le centre de contrôle des cellules cancéreuses et influence leur capacité à se réparer, à se développer et à se déplacer, selon une étude publiée aujourd'hui dans eLife .
L'étude révèle une voie importante par laquelle la fascine favorise le développement du cancer et fournit des informations sur les voies potentielles qui pourraient bloquer son action.
La fascine est connue pour contrôler les structures qui permettent aux cellules de se déplacer, en particulier l'assemblage de faisceaux d'une protéine appelée actine, qui créent les minuscules "pattes" que les cellules cancéreuses utilisent pour migrer vers des sites distants dans le corps. La fascine est également connue pour être à des niveaux beaucoup plus élevés dans la plupart des tumeurs solides, où elle aide les cellules cancéreuses à migrer et à envahir d'autres tissus. Cette invasion - ou "métastase" - des cellules tumorales est la principale raison pour laquelle de nombreux cancers sont si difficiles à traiter
"Nous avons déjà montré que la fascine réside dans le centre de contrôle de la cellule - le noyau - à certains moments du cycle de croissance de la cellule", explique l'auteur principal Campbell Lawson, associé de recherche au Randall Center for Cell and Molecular Biophysics, King's College London. , Royaume-Uni "Cependant, on ne savait pas comment le mouvement ou la fonction de la fascine dans le noyau sont contrôlés, ce qui entrave notre capacité à développer des traitements qui bloquent son rôle dans la promotion de la croissance et de la propagation du cancer."
Pour mieux comprendre la fascine, l'équipe a créé une série de lignées cellulaires cancéreuses avec et sans fascine fonctionnelle, ainsi qu'une suite de "nanocorps" de fascine marqués avec des marqueurs fluorescents, pour modifier son emplacement dans les cellules et explorer ses interactions avec d'autres protéines dans le noyau.
Ils ont découvert que la fascine est activement transportée à l'intérieur et à l'extérieur du noyau et, une fois là, elle soutient l'assemblage des faisceaux d'actine. En effet, les cellules sans fascine étaient incapables de construire des faisceaux d'actine nucléaire dans la même mesure. La fascine a également interagi avec un autre groupe de protéines importantes dans le noyau cellulaire, appelées histones. Lorsque la fascine n'est pas impliquée dans le regroupement de l'actine, elle est liée à l'histone H3, un acteur important impliqué dans l'organisation de l'ADN dans le noyau.
Compte tenu de l'interaction de la fascine avec les histones, l'équipe a cherché à savoir si la fascine était également impliquée dans les processus de réparation de l'ADN dans les cellules cancéreuses, ce qui les aide à survivre. Ils ont découvert que la réparation de l'ADN était altérée dans les cellules dépourvues de fascine, ce qui indique que la protéine pourrait être nécessaire pour que les cellules cancéreuses déclenchent leur réponse aux dommages à l'ADN causés par la chimio ou la radiothérapie. Les cellules appauvries en fascine présentaient également des modifications de leur structure de chromatine - la façon dont l'ADN est empaqueté dans la cellule - par rapport aux cellules avec des niveaux de fascine normaux.
Bien que la fascine nucléaire joue un rôle important dans l'assemblage de l'actine nucléaire, la structure et la réparation de l'ADN, elle est également importante dans le cytoplasme cellulaire, où elle aide les cellules cancéreuses à construire de minuscules appendices appelés filopodes, qui favorisent l'invasion. L'équipe a donc voulu comprendre si le déplacement de toute la fascine dans le noyau empêcherait la fonction cytoplasmique de la fascine.
Comme ils l'avaient prévu, dans les cellules à fascine nucléaire renforcée, le nombre de filopodes était considérablement réduit car il n'y avait pas de fascine dans le cytoplasme pour soutenir l'assemblage de ces structures. Les cellules ont également moins envahi les échafaudages tridimensionnels qui imitent les tissus entourant les tumeurs. Il est important de noter que les cellules qui avaient forcé la fascine nucléaire avaient des taux de croissance et une viabilité considérablement réduits car elles assemblaient de grands faisceaux d'actine stables dans le noyau, ce qui les empêchait de traverser le cycle cellulaire. Ensemble, ces résultats indiquent que, plutôt que d'essayer de trouver des moyens de bloquer la fascine, forcer tout cela dans le noyau des cellules cancéreuses pourrait empêcher leur croissance et leur mouvement.
"Notre étude fournit des informations sur un nouveau rôle de la fascine dans le contrôle du regroupement de l'actine nucléaire pour soutenir la viabilité des cellules tumorales", conclut l'auteur principal Maddy Parsons, professeur de biologie cellulaire au Randall Center for Cell and Molecular Biophysics, King's College London. "Étant donné que la fascine est à des niveaux très élevés dans de nombreuses tumeurs solides, mais pas dans les tissus normaux, cette molécule est une cible thérapeutique intéressante. Nous proposons que la promotion de l'accumulation de fascine dans le noyau des cellules cancéreuses, plutôt que de se concentrer uniquement sur son ciblage dans la cellule cytoplasme, pourrait être une approche alternative qui empêcherait à la fois la croissance et la propagation de la tumeur. » Comment les noyaux cellulaires se faufilent dans des espaces restreints