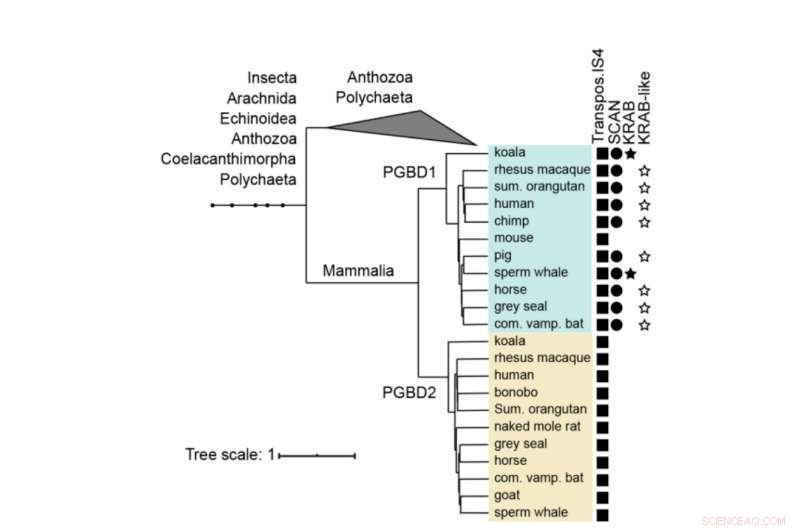
Arbre phylogénétique de PGBD1 et PGBD2. La présence des domaines dérivés de la transposase, SCAN et KRAB est montrée. Les PGBD1 et PGBD2 humains, avec les séquences les plus proches (contenant la transposase IS4) ont été alignés avec le muscle et un arbre a été construit à l'aide de MrBayes. Les domaines protéiques ont été annotés avec hmmerscan et CDD (NCBI). Le domaine KRAB a été annoté avec Phyre2. Crédit :Biologie moléculaire et évolution (2022). DOI :10.1093/molbev/msac175
L'évolution est souvent décrite comme un processus de "bricolage", qui utilise de légères modifications aux capacités préexistantes. Alors, comment les organismes font-ils évoluer de toutes nouvelles structures ?
Une nouvelle étude du Dr Zsuzsanna Izsvák du Max Delbrück Center for Molecular Medicine de l'Association Helmholtz (Max Delbrück Center) et du professeur Laurence Hurst du Milner Center for Evolution de l'Université de Bath (Royaume-Uni) a trouvé des preuves que l'évolution d'un nouveau gène sous-tend l'évolution d'une nouvelle structure trouvée dans les cellules nerveuses. Ils décrivent ce gène inhabituel appelé piggyBac Transposable Element-derived 1, ou PGBD1, dans la revue Molecular Biology and Evolution .
Les "gènes sauteurs" provoquent des mutations
PGBD1 est l'un des cinq gènes PGBD apparentés qui présentent une ressemblance distincte avec l'élément piggyBac identifié pour la première fois chez les insectes, d'où le nom dérivé de l'élément transposable piggyBac. Les éléments PiggyBac sont des "gènes sauteurs", également appelés transposons. Ils sont capables de se copier et de se déplacer d'un endroit du génome à un autre, introduisant parfois des mutations ou changeant de fonctions. Les transposons PiggyBac sont arrivés dans notre espèce par transfert horizontal, de la même manière que certains virus peuvent intégrer leur génome dans notre ADN.
Cependant, alors que les transposons piggyBac ont perdu leur capacité à sauter dans notre ADN au fil du temps, cinq gènes dérivés de l'élément transposable piggyBac (PGBD1-5) ont été fixés chez l'homme. "Nous avons cherché à découvrir quelle fonction potentiellement utile les gènes PGBD pourraient avoir", explique Zsuzsanna Izsvák. "Pour cette étude, nous nous sommes concentrés sur le PGBD1."
Parmi les cinq gènes PGBD, PGBD1 est unique en ce qu'il a également incorporé des parties d'autres gènes, ce qui donne une protéine qui a des parties supplémentaires capables de se lier à d'autres protéines et de se lier à l'ADN. PGBD1 est donc un nouveau gène qui est en partie un fragment de gène humain, en partie un gène sauteur inactif.
Le PGBD1 régule les cellules nerveuses et leurs "pièges à protéines"
Le PGBD1 ne se trouve que chez les mammifères. Il est particulièrement actif dans les cellules qui deviennent des neurones. Les chercheurs ont d'abord étudié où la protéine PGBD1 se lie à l'ADN, observant qu'elle se colle dans et autour des gènes associés au développement nerveux. Ils ont découvert que le PGBD1 contrôle le développement des cellules nerveuses en bloquant les gènes exprimés dans les cellules nerveuses matures tout en gardant activés les gènes associés aux cellules pré-nerveuses. La réduction du niveau de PGBD1 dans les cellules pré-nerveuses les a fait commencer à se développer en tant que cellules nerveuses.
L'un des gènes auxquels la protéine PGBD1 se lie a particulièrement attiré leur intérêt. NEAT1 est un étrange gène qui code pour un ARN qui, exceptionnellement, ne se transforme pas ensuite en protéine. Au lieu de cela, ce produit, un ARN non codant, constitue l'épine dorsale d'une structure physique, les parataches. Ce sont de minuscules structures dans les noyaux de certaines de nos cellules qui agissent comme des pièges pour certains ARN et protéines.
Les chercheurs ont découvert que dans les cellules pré-nerveuses, la protéine PGBD1 se lie au gène NEAT1 et l'empêche de fonctionner. Cependant, lorsque les niveaux de PGBD1 diminuent, les niveaux d'ARN NEAT1 augmentent, des parataches se forment et les cellules deviennent des cellules nerveuses matures. Le PGBD1 a donc évolué pour devenir un régulateur clé de la présence ou de l'absence de parataches, et donc le régulateur du développement des cellules nerveuses.
L'évolution n'est pas un bricolage aléatoire
Ce qui, cependant, est le plus intrigant, c'est que les parataches sont, comme PGBD1, également spécifiques aux mammifères. PGBD1 est alors un exemple rare d'un nouveau gène qui a évolué pour réguler une nouvelle structure, quoique plutôt petite. Zsuzsanna Izsvák, co-auteur principal du Max Delbrück Center, déclare :"C'est une découverte vraiment inhabituelle et fortuite. Nous savons que la duplication de gènes préexistants peut sous-tendre l'évolution de la nouveauté, mais c'est un exemple rare d'évolution faisant plus qu'un simple bricolage. Il s'agit d'un nouveau gène pour contrôler une nouvelle structure. La question passionnante est maintenant de savoir si elle joue également un rôle dans les neurones adultes.
Le co-auteur principal, le professeur Laurence Hurst du Milner Center for Evolution de l'Université de Bath, ajoute qu'ils "ont découvert comment les parataches sont contrôlées, il ne nous reste plus qu'à déterminer comment la paratache elle-même a évolué. Cela pourrait être une tâche beaucoup plus difficile. car les ARN non codants comme NEAT1 ont tendance à évoluer rapidement et sont donc difficiles à retracer au fil du temps."
Ce couplage entre NEAT1 et PGBD1 peut également être impliqué dans la schizophrénie. Bien que NEAT1 ait déjà été associé à cette maladie neurologique, l'équipe a identifié certaines mutations du PGBD1 qu'elle pourrait montrer comme étant également courantes chez les patients atteints de schizophrénie - l'une de ces mutations modifie la protéine du PGBD1 tandis que d'autres peuvent contrôler son niveau.
Le premier auteur, le Dr Tamas Raskó, au moment de l'étude, chercheur postdoctoral dans le groupe de Zsuzsanna Izsvák, a déclaré que "c'est sûrement plus qu'une coïncidence si les deux gènes sont impliqués dans la schizophrénie. Il est très inhabituel de trouver une mutation qui modifie un protéine couplée à cette maladie. Les effets de cette mutation doivent être une priorité pour des études ultérieures. Les scientifiques élucident le mystère des gènes qui sont essentiels au développement du cerveau