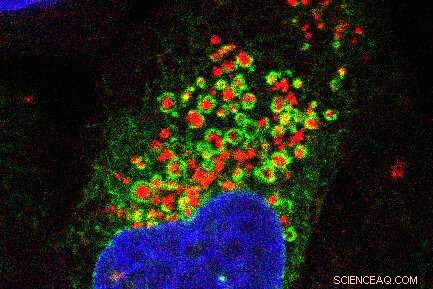
Images de microscopie à fluorescence montrant le réseau de réticulum endoplasmique (vert) s'enroulant autour des lysosomes endommagés (rouge). Le noyau cellulaire est représenté en bleu. Crédit :Jay Xiaojun Tan
Aujourd'hui dans Nature , des chercheurs de l'Université de Pittsburgh décrivent pour la première fois une voie par laquelle les cellules réparent les lysosomes endommagés, des structures qui contribuent à la longévité en recyclant les déchets cellulaires. Les découvertes sont une étape importante vers la compréhension et le traitement des maladies liées à l'âge provoquées par des lysosomes qui fuient.
"Les dommages aux lysosomes sont une caractéristique du vieillissement et de nombreuses maladies, en particulier les troubles neurodégénératifs tels que la maladie d'Alzheimer", a déclaré l'auteur principal Jay Xiaojun Tan, Ph.D., professeur adjoint de biologie cellulaire à la Pitt's School of Medicine et membre de l'Aging Institute, un partenariat entre Pitt et l'UPMC. "Notre étude identifie une série d'étapes qui, selon nous, constituent un mécanisme universel de réparation lysosomale, que nous avons nommé la voie PITT en clin d'œil à l'Université de Pittsburgh."
En tant que système de recyclage de la cellule, les lysosomes contiennent de puissantes enzymes digestives qui dégradent les déchets moléculaires. Ces contenus sont protégés contre les dommages aux autres parties de la cellule grâce à une membrane qui agit comme une clôture à mailles losangées autour d'une installation de déchets dangereux. Bien que des ruptures puissent se produire dans cette clôture, une cellule saine répare rapidement les dégâts. Pour en savoir plus sur ce processus de réparation, Tan s'est associé à l'auteur principal Toren Finkel, M.D., Ph.D., directeur de l'Institut du vieillissement et professeur distingué de médecine à la Pitt's School of Medicine.
Tout d'abord, Tan a expérimentalement endommagé des lysosomes dans des cellules cultivées en laboratoire, puis a mesuré les protéines qui sont arrivées sur les lieux. Il a découvert qu'une enzyme appelée PI4K2A s'accumulait sur les lysosomes endommagés en quelques minutes et générait des niveaux élevés d'une molécule de signalisation appelée PtdIns4P.
"PtdIns4P est comme un drapeau rouge. Il dit à la cellule :'Hé, nous avons un problème ici'", a déclaré Tan. "Ce système d'alerte recrute alors un autre groupe de protéines appelées ORP."
Les protéines ORP fonctionnent comme des attaches, a expliqué Tan. Une extrémité de la protéine se lie au drapeau rouge PtdIns4P sur le lysosome, et l'autre extrémité se lie au réticulum endoplasmique, la structure cellulaire impliquée dans la synthèse des protéines et des lipides.
"Le réticulum endoplasmique s'enroule autour du lysosome comme une couverture", a ajouté Finkel. "Normalement, le réticulum endoplasmique et les lysosomes se touchent à peine, mais une fois que le lysosome a été endommagé, nous avons constaté qu'ils s'enlaçaient."
Grâce à cette étreinte, le cholestérol et un lipide appelé phosphatidylsérine sont acheminés vers le lysosome et aident à colmater les trous dans la barrière membranaire.
La phosphatidylsérine active également une protéine appelée ATG2, qui agit comme un pont pour transférer d'autres lipides vers le lysosome, l'étape finale de réparation de la membrane dans la voie nouvellement décrite de fixation membranaire et de transport des lipides PITT ou phosphoinositide.
"Ce qui est beau dans ce système, c'est que tous les composants de la voie PITT étaient connus pour exister, mais ils n'étaient pas connus pour interagir dans cette séquence ou pour la fonction de réparation des lysosomes", a déclaré Finkel. "Je crois que ces découvertes auront de nombreuses implications pour le vieillissement normal et pour les maladies liées à l'âge."
Les chercheurs soupçonnent que chez les personnes en bonne santé, de petites ruptures de la membrane du lysosome sont rapidement réparées par la voie PITT. Mais si les dommages sont trop importants ou si la voie de réparation est compromise, en raison de l'âge ou de la maladie, les lysosomes qui fuient s'accumulent. Dans la maladie d'Alzheimer, la fuite des fibrilles tau des lysosomes endommagés est une étape clé dans la progression de la maladie.
Lorsque Tan a supprimé le gène codant pour la première enzyme de la voie, PI4K2A, il a constaté que la propagation des fibrilles tau augmentait considérablement, suggérant que des défauts de la voie PITT pourraient contribuer à la progression de la maladie d'Alzheimer. Dans des travaux futurs, les chercheurs prévoient de développer des modèles de souris pour comprendre si la voie PITT peut protéger les souris contre le développement de la maladie d'Alzheimer. Les chercheurs réalisent le profilage métabolomique de lysosomes agrandis individuels